题目内容
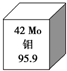 我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )
我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )| A、95Mo原子核内有53个中子 |
| B、95Mo原子核外有42个电子 |
| C、92Mo、95Mo、98Mo互为同位素 |
| D、92Mo、95Mo、98Mo的化学性质有较大的不同 |
考点:同位素及其应用,质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:A.质子数=原子序数,中子数=质量数-质子数;
B.核外电子数=质子数;
C.有相同质子数、不同中子数的原子或同一元素的不同核素互为同位素;
D.同位素的化学性质几乎相同.
B.核外电子数=质子数;
C.有相同质子数、不同中子数的原子或同一元素的不同核素互为同位素;
D.同位素的化学性质几乎相同.
解答:
解:A.钼元素为42号元素,质子数=原子序数=42,中子数=质量数-质子数=95-42=53,故A正确;
B.核外电子数=质子数=42,故B正确;
C.92Mo、95Mo、98Mo质子数相同,中子数不同,互为同位素,故C正确;
D.92Mo、95Mo、98Mo互为同位素,故化学性质几乎相同,故D错误,
故选D.
B.核外电子数=质子数=42,故B正确;
C.92Mo、95Mo、98Mo质子数相同,中子数不同,互为同位素,故C正确;
D.92Mo、95Mo、98Mo互为同位素,故化学性质几乎相同,故D错误,
故选D.
点评:本题考查同位素的概念和性质、粒子数之间的数量关系,难度不大.对于同位素、核素等概念的区别是考试的热点问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式中,属于水解反应的是( )
| A、CH3COOH+H2O?CH3COO-+H3O+ |
| B、CO2+H2O?HCO3-+H+ |
| C、HCO3-+H2O?H2CO3+OH- |
| D、HS-+H2O?S2-+H3O+ |
用NA表示阿伏加德罗常数,以下说法错误的是( )
| A、25℃,1.01×105Pa时,4g氦气所含的原子个数为NA |
| B、0.1 mol的OH-中所含电子个数为NA |
| C、120 g由NaHSO4和KHSO3组成的混合物中含有的硫原子数为NA |
| D、8.4 g的NaHCO3中含有的阳离子个数为0.2NA |
构造原理揭示的电子排布能级顺序,实质是各能级能量高低.若以E(nx)表示某能级的能量,以下各式中正确的是( )
①E(4s)>E(3s)>E(2s)>E(1s)
②E(3d)>E(4s)>E(3p)>E(3s)
③E(5s)>E(4f)>E(4s)>E(3d)
④E(5s)>E(4s)>E(4f)>E(3d)
①E(4s)>E(3s)>E(2s)>E(1s)
②E(3d)>E(4s)>E(3p)>E(3s)
③E(5s)>E(4f)>E(4s)>E(3d)
④E(5s)>E(4s)>E(4f)>E(3d)
| A、①② | B、①②④ |
| C、②③④ | D、①②③④ |
下列电离方程式正确的是( )
| A、H2S?2H++S2- |
| B、HClO=H++ClO- |
| C、CH3COONa=Na++CH3COO- |
| D、NaHCO3?Na++HCO3- |
下列叙述不正确的是(设NA为阿伏伽德罗常数)( )
| A、1mol氢气为2克 |
| B、H2O的摩尔质量为18g?mol-1 |
| C、44克CO2的体积为22.4L |
| D、9.8g H2SO4含0.1NA个H2SO4分子 |
下列电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用胶头滴管滴入5ml盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用胶头滴管滴入5ml盐酸于试管中,试回答下列问题: