题目内容
8.下列化学用语错误的是( )| A. | 氯化氢分子的电子式: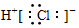 | B. | 乙烯的最简式:CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: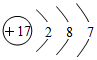 |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.最简式是用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
C.根据苯是由6个碳原子和6个氢原子组成的平面型分子;
D.氯原子含有17个质子和17个电子.
解答 解:A.氯化氢分子中不存在氢离子和氯离子,氯化氢的电子式为: ,故A错误;
,故A错误;
B.乙烯的分子式为:CH2=CH2,最简式为:CH2,故B正确;
C.苯是由6个碳原子和6个氢原子组成的平面型分子,分子式为C6H6,故C正确;
D.氯原子含有17个质子和17个电子,原子核外有3个电子层,最外层有7个电子,原子结构示意图为: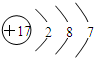 ,故D正确;
,故D正确;
故选A.
点评 本题主要考查常用化学用语的书写,难度不大,掌握常用化学用语的书写,注意共价化合物和离子化合物电子式书写的区别.

练习册系列答案
相关题目
19.零价铁(Fe)除去水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图所示.的反应原理如图1所示.
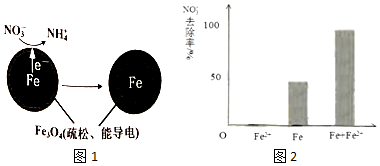
正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
pH=4.5时,NO3-的去除率低.其原因是因为铁表面生成不导电的FeO(OH),将铁全部覆盖,阻止反应进一步发生.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.pH=4.5(其他条件相同)
Ⅱ.高铁酸钠Na2FeO4
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式为.
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式.
(1)Fe还原水体中NO3-的反应原理如图所示.的反应原理如图1所示.

正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.pH=4.5(其他条件相同)
Ⅱ.高铁酸钠Na2FeO4
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式为.
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式.
16.下列物质中最简式相同,但既不是同系物,也不是同分异构体,又不含相同官能团的是( )
| A. | CH3CH=CH2和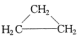 | B. | 乙炔和苯 | C. |  和 和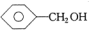 | D. | 乙酸和甲酸甲酯 |
3.氢化钠(NaH)是一种白色的离子化合物.NaH与水反应放出氢气.下列叙述中正确的是( )
| A. | NaH中氢是+1价 | |
| B. | NaH中阴离子半径比锂离子半径小 | |
| C. | NaH中阴离子的电子层排布与氦原子相同 | |
| D. | NaH中阴离子可被还原成氢气 |
13.甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢被苯基取代,则可得到的分子为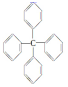 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )
 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 此分子中有极性键和非极性键 | D. | 此物质属芳香烃类物质 |
 金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).
金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况). CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.
CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.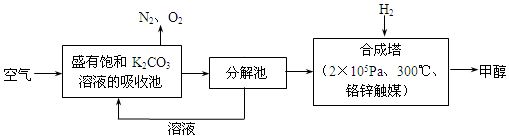

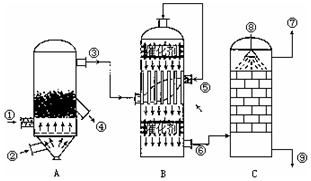
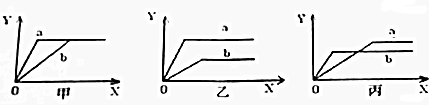
 .
.