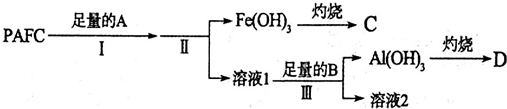
题目内容
16. A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:(1)A、B、C的第一电离能由小到大的顺序是C<O<N(用对应的元素符号表示);基态D原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1.
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取SP2杂化;BC${\;}_{3}^{-}$的空间构型为平面三角形(用文字描述).
(3)1mol AB-中含有的π键数目为2NA.
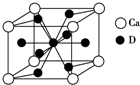
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是1:5.
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.
分析 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A为C原子; C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构且核电荷数介于A与C之间,因此B为N元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D为Cu元素.据此解答.
解答 解:A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A为C原子; C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构且核电荷数介于A与C之间,因此B为N元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D为Cu元素.
(1)同一周期,从左往右,随着核电荷数的增大,第一电离能不断增大,但ⅡA族、ⅤA族的第一电离能大于其相邻元素,因此C、N、O第一电离能由小到大的顺序是<O<N;D原子为29号Cu原子,因此基态D原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:C<O<N;1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)A的最高价氧化物对应的水化物是H2CO3,该分子的中心原子C原子的价层电子对个数是3,且不含有孤对电子,因此采取的是SP2杂化;BC${\;}_{3}^{-}$为NO3-,空间构型为平面三角形;
故答案为:SP2;平面三角形;
(3)由于CN-与N2互为等电子体,1mol N2中含有2molπ键,则1mol CN-中含有的π键数目为2NA;
故答案为:2NA;
(4)根据合金的晶胞结构示意图,该晶胞中Ca原子个数为$8×\frac{1}{8}=1$,Cu原子个数为$8×\frac{1}{2}+1=5$,则Ca和Cu原子的个数比为1:5;
故答案为:1:5;
(5)Ca、Cu合金化学式为CaCu5,由于镧镍合金与上述合金都具有相同类型的晶胞结构XYn,所以该镧镍合金中的n=5;氢在合金中的密度为:
$ρ=\frac{\frac{M}{{N}_{A}}}{V}=\frac{\frac{45}{6.02×1{0}^{23}}}{9.0×1{0}^{23}}g•c{m}^{-3}=0.083g•c{m}^{-3}$.
故答案为:5;0.083 g•cm-3.
点评 本题考查了元素电离能、原子轨道杂化方式与类型的判断、原子核外电子的排布以及晶胞的计算等知识点,题目综合性较强,注意根据价层电子对互斥理论、构造原理等知识来分析解答,题目难度中等.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw变小 | |
| C. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
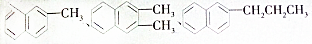 都属于萘(结构简式:
都属于萘(结构简式: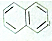 的同系物,则萘和萘的同系物分子组成通式是( )
的同系物,则萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-12(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| C. | 加水稀释CH3COONa溶液,溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值变小 | |
| D. | 25℃时,pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4 |
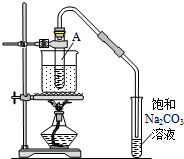 按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )| A. | 试管A中没有发生反应 | |
| B. | 热源小、水量多,水浴升温速度太慢 | |
| C. | 产物蒸汽在试管A上部全部被冷凝回流 | |
| D. | 产物已全部溶解在饱和Na2CO3溶液中 |
| 酸 | 电离方程式 | 电离常数 K/mol•L-1 |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.26×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?K值越大,电离程度越大,酸性越强;
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是H3PO4,最弱的是HPO42-;
(4)H3PO4的Ka1、Ka2、Ka3之间存在数量上的规律,此规律是在数值上相差很大,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.