题目内容
8.下列有关电解质溶液中粒子浓度关系正确的是( )| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| C. | 加水稀释CH3COONa溶液,溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值变小 | |
| D. | 25℃时,pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4 |
分析 A、含等物质的量的NaHC2O4和Na2C2O4的溶液中存在物料守恒:2c(Na+)═3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)];
B、等pH的KOH溶液、Ba(OH)2溶液中,前者的浓度是后者溶液浓度的2倍,据此回答;
C、溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{Kw}{Ka}$,据此回答;
D、由于盐酸和醋酸溶液的pH相等,两溶液中氢离子浓度相等,故将两溶液混合后氢离子浓度不变,溶液的pH不变.
解答 解:A、含等物质的量的NaHC2O4和Na2C2O4的溶液中存在物料守恒:2c(Na+)═3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故A错误;
B、等pH的KOH溶液、Ba(OH)2溶液中,前者的浓度是后者溶液浓度的2倍,c(K+)=2c(Ba2+),故B错误;
C、溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{Kw}{Ka}$,加水稀释,Ka和Kw都不变,所比值不变,故C错误;
D、由于盐酸和醋酸溶液的pH相等,两溶液中氢离子浓度相等,故将两溶液混合后氢离子浓度不变,溶液的pH不变,混合后pH=4,故D正确.
故选D.
点评 题考查了溶液酸碱性与溶液pH的关系、溶液中离子浓度大小比较等知识,题目难度不大,注意溶液中离子浓度关系的守恒关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 0.1mol•L-1的NaOH溶液中含Na+数目为0.1NA | |
| B. | 标准状况下,2.24L乙酸中含碳原子数目为0.2NA | |
| C. | 12gC60中含质子总数为6NA | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数目为0.2NA |
6.分子式为C6H12O2的有机物,该物质能发生银镜反应,且在酸性条件下水解为A和B.不考虑立体异构,满足条件的该有机物的同分异构体共有( )
| A. | 8种 | B. | 12种 | C. | 15种 | D. | 20种 |
 .
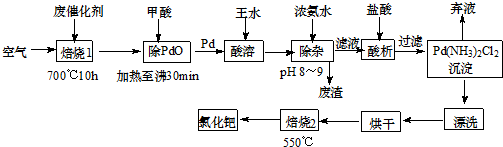
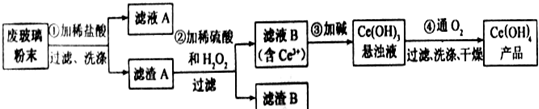
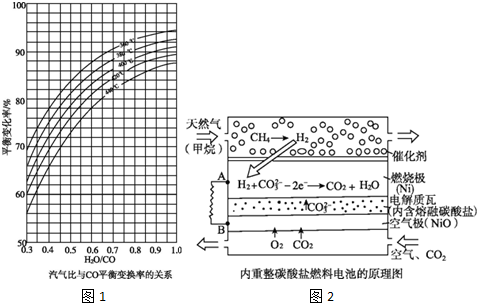
.
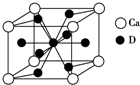 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: