题目内容
13.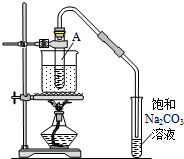 按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )| A. | 试管A中没有发生反应 | |
| B. | 热源小、水量多,水浴升温速度太慢 | |
| C. | 产物蒸汽在试管A上部全部被冷凝回流 | |
| D. | 产物已全部溶解在饱和Na2CO3溶液中 |
分析 乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,反应需在加热条件下进行,生成的乙酸乙酯不溶于饱和碳酸钠溶液,长导管起到冷凝回流的作用,以此解答该题.
解答 解:A.乙醇、乙酸在浓硫酸作用下,加热可发生酯化反应生成乙酸乙酯,故A错误;
B.如烧杯内加水过多,反应温度较低,则反应较慢,可能收集不到乙酸乙酯,故B正确;
C.如生成乙酸乙酯较少,产物蒸汽在试管A上部全部被冷凝回流,也可能收集不到乙酸乙酯,故C正确;
D.乙酸乙酯不溶于饱和碳酸钠溶液,故D错误.
故选AD.
点评 本题考查乙酸乙酯的制备,为高频考点,题目难度中等,本题注意把握乙酸乙酯的制备原理和实验方法,学习中注重实验评价能力的培养.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
18.工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等.
根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合2.169×104mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为3.144g/L;阴极产生NaOH4.273×104mol(保留四位有效数字,下同).
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化).
若某个电解槽每小时进NaOH溶液52.000kg,得到碱溶液初产品90.416kg,则阳极区每小时加入NaCl溶液0.1950m3.取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水2.411L.
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力.在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g.在一定条件下,将该溶液制成晶体,质量最多为1.335g.通过列式计算,写出该晶体的化学式.
根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合2.169×104mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为3.144g/L;阴极产生NaOH4.273×104mol(保留四位有效数字,下同).
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化).
| 阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
| 进料液 | 0.30 | 310 |
| 电解后 | 0.32 | 210 |
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力.在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g.在一定条件下,将该溶液制成晶体,质量最多为1.335g.通过列式计算,写出该晶体的化学式.
3.某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )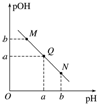

| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q点水的电离程度在MN直线上最大 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答: A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
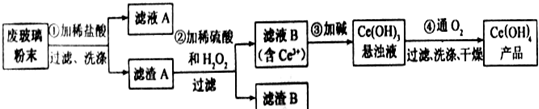
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: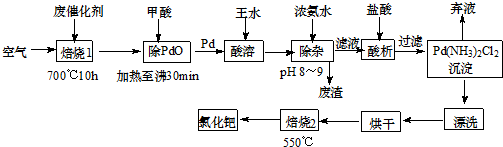
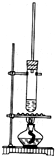 已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)
已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)