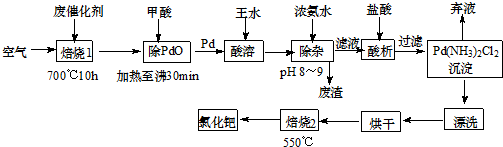
题目内容
1.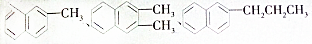 都属于萘(结构简式:
都属于萘(结构简式: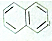 的同系物,则萘和萘的同系物分子组成通式是( )
的同系物,则萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-12(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
分析 分析所给的有机物结构简式可以得出:该系列分子结构均含一个萘环,共含有7个不饱和度,据此解答即可.
解答 解:该系列分子结构均含一个萘环,共含有7个不饱和度,故氢原子个数为:2n+2-14=2n-12.萘的同系物的通式为CnH2n-12,还须注意的是萘的碳原子数最少为10,故:n≥10.
故选D.
点评 本题主要考查的是芳香烃、烃基和同系物,难度较大,注意同系物必须结构相似,计算出不饱和度是解决本题的关键.

练习册系列答案
相关题目
11.下列食品添加剂与类别对应正确的一组是( )
| A. | 着色剂---胡萝卜素、苯甲酸钠 | B. | 调味剂---亚硝酸钠、味精 | ||
| C. | 防腐剂---氯化钠、柠檬黄 | D. | 营养强化剂---酱油中加铁 |
12.关于元素在周期表中的位置、原子结构和性质的关系,说法正确的是( )
| A. | 非金属元素间形成的化学键都是共价键 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的族序数 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 最外层电子数相同的原子属于同一族且化学性质相似 |
18.工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等.
根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合2.169×104mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为3.144g/L;阴极产生NaOH4.273×104mol(保留四位有效数字,下同).
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化).
若某个电解槽每小时进NaOH溶液52.000kg,得到碱溶液初产品90.416kg,则阳极区每小时加入NaCl溶液0.1950m3.取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水2.411L.
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力.在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g.在一定条件下,将该溶液制成晶体,质量最多为1.335g.通过列式计算,写出该晶体的化学式.
根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合2.169×104mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为3.144g/L;阴极产生NaOH4.273×104mol(保留四位有效数字,下同).
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化).
| 阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
| 进料液 | 0.30 | 310 |
| 电解后 | 0.32 | 210 |
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力.在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g.在一定条件下,将该溶液制成晶体,质量最多为1.335g.通过列式计算,写出该晶体的化学式.
19.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是Mn2+对该反应有催化作用.
②请你帮助该小组同学完成实验方案,并填写表中空白
③若该小组同学提出的假设成立,应观察到反应过程中溶液褪色时间减少现象.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
(1)根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是Mn2+对该反应有催化作用.
②请你帮助该小组同学完成实验方案,并填写表中空白
| 实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
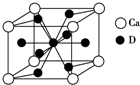 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: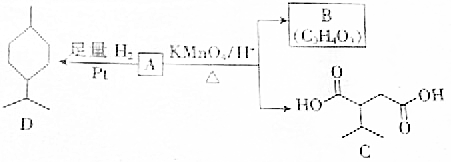
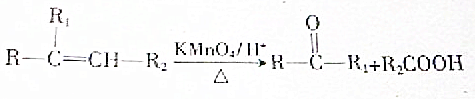
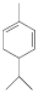 .A与等物质量的溴单质反应的产物有3种.
.A与等物质量的溴单质反应的产物有3种.