题目内容
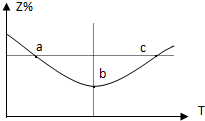 在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )| A、升高温度,平衡常数减小 |
| B、Z在a、c两点的反应速率相等 |
| C、b点时,Z的转化率最小 |
| D、平衡时充入惰性气体时,平衡向逆反应方向移动 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:温度在b℃之前,升高温度,Z的含量减小,温度在b℃之后,升高温度,Z的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,反应向正反应进行,最低点之后,各点为平衡点,升高温度Z的含量增大,平衡向逆反应方向移动,故正反应为放热反应.
解答:
解:A、正反应为放热反应,升高温度,平衡常数减小,故A正确;
B、温度越高反应速率越快,所以c点速率快,故B错误;
C、b点时,Z的转化率最大,故C错误;
D、充入惰性气体时,浓度不变平衡不移动,故D错误;
故选:A.
B、温度越高反应速率越快,所以c点速率快,故B错误;
C、b点时,Z的转化率最大,故C错误;
D、充入惰性气体时,浓度不变平衡不移动,故D错误;
故选:A.
点评:本题考查化学平衡图象、化学反应速率和平衡的影响因素、化学平衡常数等,难度中等,判断最低点及之后各点为平衡点是解题的关键.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
化学与生产、生活密切相关,下列说法正确的是( )
| A、淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象 |
| B、合金、光导纤维、碳纤维、玻璃钢都属于复合材料 |
| C、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| D、光化学烟雾、臭氧空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关 |
下列各反应达到化学平衡后,加压能使化学平衡向逆反应方向移动的是( )
| A、2NO2?N2O4 |
| B、C(s)+CO2?2CO |
| C、N2+3H2?2NH3 |
| D、H2S?H2+S(s) |
在0.1mol?L-1的醋酸溶液中,存在电离平衡CH3COOH?CH3COO-+H+,如果要使平衡向逆反应方向移动,同时增大c(H+),应采用的方法是( )
| A、加入0.01 mol?L-1的CH3COOH溶液 |
| B、加入CH3COONa固体 |
| C、稀释 |
| D、加入浓盐酸 |
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )| A、正反应是放热反应,m+n>p+q |
| B、逆反应是放热反应,m+n>p+q |
| C、正反应是放热反应,m+n<p+q |
| D、逆反应是放热反应,m+n<p+q |
下列实验方法正确的是( )
| A、向无色溶液中加入氯化钡溶液有白色沉淀出现,再加入盐酸,沉淀不消失,则溶液中一定含有SO42- |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中可能含有K+ |
| C、用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,更换烧杯后继续打开分液漏斗活塞,放出上层液体 |
| D、检验某溶液中是否含有Fe2+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe2+ |
下列说法正确的是( )
| A、化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
| B、凡是放热反应都是自发的,吸热反应都是非自发的 |
| C、若一个反应的平衡常数越大,则表示该反应速率也越大 |
| D、升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |