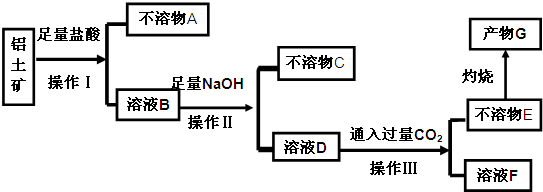
题目内容
写出下列物质在水中的电离方程式:
NaHSO4
HClO
Al(OH)3
Ca(OH)2
H2CO3 .
NaHSO4
HClO
Al(OH)3
Ca(OH)2
H2CO3
考点:电离方程式的书写
专题:
分析:先判断电解质的强弱,强电解质完全电离用“═”,弱电解质部分电离用可逆号,电离方程式应遵循质量守恒定律和电荷守恒,并注意原子团不可拆分来解答.
解答:
解:NaHSO4为强电解质,在水中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-;
HClO为弱电解质,在水中部分电离,电离方程式为:HClO H++ClO-,
H++ClO-,
故答案为:HClO H++ClO-;
H++ClO-;
Al(OH)3为弱电解质,在水中部分电离,电离方程式为:Al(OH)3 Al3++3OH-,
Al3++3OH-,
故答案为:Al(OH)3 Al3++3OH-;
Al3++3OH-;
Ca(OH)2为强电解质,在水中完全电离,电离方程式为:Ca(OH)2=Ca2++2OH-,
故答案为:Ca(OH)2=Ca2++2OH-;
H2CO3为弱电解质,在水中部分电离,电离方程式为:H2CO3 H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-,
H++CO32-,
故答案为:H2CO3 H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-.
H++CO32-.
故答案为:NaHSO4=Na++H++SO42-;
HClO为弱电解质,在水中部分电离,电离方程式为:HClO
 H++ClO-,
H++ClO-,故答案为:HClO
 H++ClO-;
H++ClO-;Al(OH)3为弱电解质,在水中部分电离,电离方程式为:Al(OH)3
 Al3++3OH-,
Al3++3OH-,故答案为:Al(OH)3
 Al3++3OH-;
Al3++3OH-;Ca(OH)2为强电解质,在水中完全电离,电离方程式为:Ca(OH)2=Ca2++2OH-,
故答案为:Ca(OH)2=Ca2++2OH-;
H2CO3为弱电解质,在水中部分电离,电离方程式为:H2CO3
 H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-,
H++CO32-,故答案为:H2CO3
 H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-.
H++CO32-.
点评:本题考查电离方程式的书写,明确电解质的强弱、物质中的原子团及电离方程式的书写方法即可解答,注意多元弱酸分步电离.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列反应中,观察不到颜色变化的是( )
| A、往氨水中滴加酚酞 |
| B、往稀硫酸中通入氨气 |
| C、往品红溶液中通人足量二氧化硫气体 |
| D、氯气通入淀粉碘化钾溶液中 |
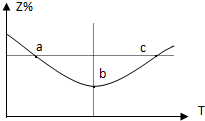 在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )| A、升高温度,平衡常数减小 |
| B、Z在a、c两点的反应速率相等 |
| C、b点时,Z的转化率最小 |
| D、平衡时充入惰性气体时,平衡向逆反应方向移动 |

 链状结构的同分异构体最多有
链状结构的同分异构体最多有