题目内容
耐火材料主要成分为MgO和A12O3,某厂用蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)作原料生产耐火材料.化学课外小组同学用蛭石进行了以下实验:
Ⅰ.查阅资料得知0.1mol/L的离子浓度时,氢氧化物沉淀时的pH为
Ⅱ.实验流程如下(固体A、F为一种成份):
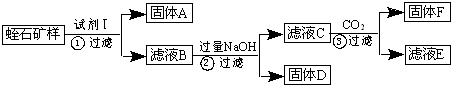
请回答以下问题:
(1)写出下列物质化学式:试剂I ;固体F .
(2)步骤②B生成C的离子方程式为 .
(3)要保证固体D杂质尽量少,步聚②调节溶液的pH合理范围是 :
A.12.4~13 B.10~10.8 C.3.7~5.2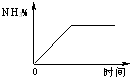
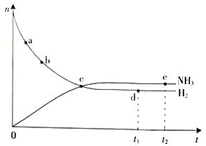
(4)固体D可用来生产合成氨的表面催化剂.如图表示无催化剂时NH3的百分含量随时间变化曲线,请在图上用虚线画出有催化剂时的曲线.
(5)已知:N2 (g)+3H2 (g)═2NH3 (g)△H=-a kJ?mol-1
2H2O(1)═2H2 (g)+O2 (g)△H=+b kJ?mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为 .
Ⅰ.查阅资料得知0.1mol/L的离子浓度时,氢氧化物沉淀时的pH为
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 10.4 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 12.4 | 5.2 | 完全溶解:10.8 |

请回答以下问题:
(1)写出下列物质化学式:试剂I
(2)步骤②B生成C的离子方程式为
(3)要保证固体D杂质尽量少,步聚②调节溶液的pH合理范围是
A.12.4~13 B.10~10.8 C.3.7~5.2

(4)固体D可用来生产合成氨的表面催化剂.如图表示无催化剂时NH3的百分含量随时间变化曲线,请在图上用虚线画出有催化剂时的曲线.
(5)已知:N2 (g)+3H2 (g)═2NH3 (g)△H=-a kJ?mol-1
2H2O(1)═2H2 (g)+O2 (g)△H=+b kJ?mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)加入试剂Ⅰ酸溶过滤,得到固体A为SiO2,滤液B含有Mg2+、Fe3+、Al3+,加入过量氢氧化钠溶液过滤得到固体D为Mg(OH)2、Fe(OH)3,滤液C为NaAlO2溶液,通入二氧化碳气体生成氢氧化铝沉淀F和滤液E为碳酸氢钠溶液;
(1)上述分析可知试剂Ⅰ是稀硫酸或稀盐酸;固体F为氢氧化铝;
(2)步骤②B生成C的反应是铝离子和过量氢氧根离子反应生成偏铝酸盐;
(3)分析图表数据保证镁离子和铁离子全部沉淀,铝离子全部变化为偏铝酸盐;
(4)固体D为Mg(OH)2、Fe(OH)3,用来生产合成氨的表面催化剂,催化剂改变反应速率不改变化学平衡,据此画出曲线变化;
(5)结合热化学方程式和盖斯定律计算得到所需热化学方程式.
(1)上述分析可知试剂Ⅰ是稀硫酸或稀盐酸;固体F为氢氧化铝;
(2)步骤②B生成C的反应是铝离子和过量氢氧根离子反应生成偏铝酸盐;
(3)分析图表数据保证镁离子和铁离子全部沉淀,铝离子全部变化为偏铝酸盐;
(4)固体D为Mg(OH)2、Fe(OH)3,用来生产合成氨的表面催化剂,催化剂改变反应速率不改变化学平衡,据此画出曲线变化;
(5)结合热化学方程式和盖斯定律计算得到所需热化学方程式.
解答:
解:蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)加入试剂Ⅰ酸溶过滤,得到固体A为SiO2,滤液B含有Mg2+、Fe3+、Al3+,加入过量氢氧化钠溶液过滤得到固体D为Mg(OH)2、Fe(OH)3,滤液C为NaAlO2溶液,通入二氧化碳气体生成氢氧化铝沉淀F和滤液E为碳酸氢钠溶液;
(1)上述分析可知试剂Ⅰ是稀硫酸或稀盐酸;固体F为氢氧化铝,Al(OH)3,故答案为:稀硫酸或稀盐酸,Al(OH)3;
(2)步骤②B生成C的反应是铝离子和过量氢氧根离子反应生成偏铝酸盐,反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
(3)分析图表数据保证镁离子和铁离子全部沉淀,铝离子全部变化为偏铝酸盐,调节溶液PH为10.4~10.8,B符合,故答案为:B;
(4)固体D为Mg(OH)2、Fe(OH)3,用来生产合成氨的表面催化剂,催化剂改变反应速率不改变化学平衡,据此画出曲线变化,为 ,
,
故答案为: ;
;
(5)结合热化学方程式和盖斯定律计算得到所需热化学方程式,
①N2 (g)+3H2 (g)═2NH3 (g)△H=-a kJ?mol-1
②2H2O(1)═2H2 (g)+O2 (g)△H=+b kJ?mol-1
依据盖斯定律计算②×3+①×2得到:2N2 (g)+6H2O (1)=4NH3(g)+3O2(g)△H=-(2a-3b) kJ?mol-1 ;
则NH3被O2氧化为N2和H2O的热化学方程式为;4NH3(g)+3O2(g)=2N2 (g)+6H2O (1)△H=(2a-3b) kJ?mol-1 ;
故答案为:4NH3(g)+3O2(g)=2N2 (g)+6H2O (1)△H=(2a-3b) kJ?mol-1 .
(1)上述分析可知试剂Ⅰ是稀硫酸或稀盐酸;固体F为氢氧化铝,Al(OH)3,故答案为:稀硫酸或稀盐酸,Al(OH)3;
(2)步骤②B生成C的反应是铝离子和过量氢氧根离子反应生成偏铝酸盐,反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
(3)分析图表数据保证镁离子和铁离子全部沉淀,铝离子全部变化为偏铝酸盐,调节溶液PH为10.4~10.8,B符合,故答案为:B;
(4)固体D为Mg(OH)2、Fe(OH)3,用来生产合成氨的表面催化剂,催化剂改变反应速率不改变化学平衡,据此画出曲线变化,为
 ,
,故答案为:
 ;
;(5)结合热化学方程式和盖斯定律计算得到所需热化学方程式,
①N2 (g)+3H2 (g)═2NH3 (g)△H=-a kJ?mol-1
②2H2O(1)═2H2 (g)+O2 (g)△H=+b kJ?mol-1
依据盖斯定律计算②×3+①×2得到:2N2 (g)+6H2O (1)=4NH3(g)+3O2(g)△H=-(2a-3b) kJ?mol-1 ;
则NH3被O2氧化为N2和H2O的热化学方程式为;4NH3(g)+3O2(g)=2N2 (g)+6H2O (1)△H=(2a-3b) kJ?mol-1 ;
故答案为:4NH3(g)+3O2(g)=2N2 (g)+6H2O (1)△H=(2a-3b) kJ?mol-1 .
点评:本题考查了流程分析应用,物质分离提纯的方法和分析判断,热化学方程式计算分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列途径制取:

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )
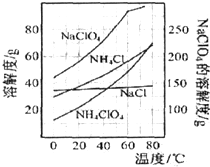

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )

| A、制得粗产品的反应原理为:NH4Cl+NaClO4=NaCl+NH4ClO4↓ |
| B、上述流程中操作Ⅰ为冷却结晶,操作Ⅱ为重结晶 |
| C、洗涤粗产品时,宜用冷水洗涤 |
| D、上述流程中蒸发浓缩时,蒸发至剩余少量溶液时,应停止加热,利用余热将其蒸干,防止晶体飞溅 |
下表中与化学反应相对应的方程式中,正确的是( )
A、化学反应:以石墨作电极电解氯化钠溶液,离子方程式:2Cl-+2H2O
| ||||
| B、化学反应:以银作电极电解硝酸银溶液,离子方程式4Ag++2H2O=4Ag+O2↑+4H+ | ||||
| C、化学反应:铅蓄电池正极反应,离子方程式:PbO2+4H++2e-═Pb2++2H2O | ||||
| D、化学反应:氢氧燃料电池(KOH做电解液)负极反应,离子方程式:O2+4e-+2H2O=4OH- |
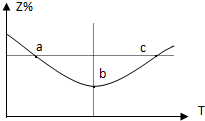 在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )| A、升高温度,平衡常数减小 |
| B、Z在a、c两点的反应速率相等 |
| C、b点时,Z的转化率最小 |
| D、平衡时充入惰性气体时,平衡向逆反应方向移动 |
下列各项叙述中,正确的是( )
| A、钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量 |
| B、价电子排布为4s24p3的元素位于第四周期第ⅢA族 |
| C、2p和3p轨道形状均为哑铃状,能量也相等 |
| D、在现代化学中,常利用原子光谱上的特征谱线来鉴定元素 |
Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )
| A、Na2CO3是碱 |
| B、Na2CO3是盐 |
| C、Na2CO3是正盐 |
| D、Na2CO3是钠盐 |
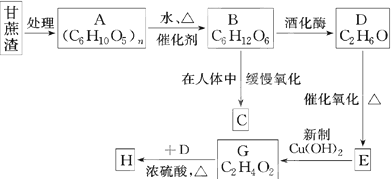
 链状结构的同分异构体最多有
链状结构的同分异构体最多有
 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题: