题目内容
13.下列物质属于原子晶体的是( )| A. | HCl | B. | He | C. | Si | D. | NaCl |
分析 相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体,常见的原子晶体是周期系第ⅣA族元素的一些单质和某些化合物,例如金刚石、硅晶体、SiO2、SiC等.
解答 解:A、HCl以分子间作用力结合形成的分子晶体,故A不选;
B、He以分子间作用力结合形成的分子晶体,故B不选;
C、Si晶体属于原子晶体,故C选;
D、氧化钠是以离子键结合形成的离子晶体,故D不选.
故选C.
点评 本题考查晶体类型的判断,题目难度不大,注意晶体类型的分类和区别.

练习册系列答案
相关题目
3.一种锂钢可充电电池的结构如图所示,下列说法正确的是( )
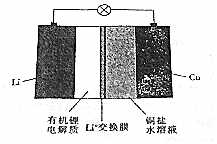

| A. | 放电时,正极上有金属锂析出 | |
| B. | 充电时,阳极区溶液中c(Cu2+)增大 | |
| C. | 放电时,负极区溶液中c(OH-)增大 | |
| D. | 充电时,阴极的电极反应式为Cu2++2e-═Cu |
4.下列有关物质的性质与用途具有对应关系的是( )
| A. | 浓H2SO4具有氧化性,可用作SO2的干燥剂 | |
| B. | H2O2能使蛋白质变性,可用作医疗的消毒剂 | |
| C. | C2H4气体具有可燃性,可用作果实的催熟剂 | |
| D. | Fe2O3水溶液显弱酸性,可用作H2S的脱除剂 |
1.在一密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1.当反应达到平衡时,可能存在的数据是( )
| A. | SO2为0.4 mol•L-1,O2为0.2 mol•L-1 | |
| B. | SO2为0.2 mol•L-1 | |
| C. | SO2、SO3分别为0.15 mol•L-1、0.3 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
8.香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示.下列有关香天竺葵醇的说法错误的是( )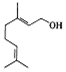

| A. | 分子中含有两种官能团 | |
| B. | lmol该物质与lmolHBr发生加成反应的产物共有5种(不考虑立体异构) | |
| C. | 使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同 | |
| D. | 香天竺葵醇能发生加聚反应和氧化反应 |
18.下列过程中△H<0的是( )
| A. | 铝热反应 | B. | 煅烧石灰石 | ||
| C. | 硝酸铵的溶解 | D. | 高温下木炭还原二氧化碳 |
5.某元素原子最外层只有1个电子,它与卤素相结合时,所形成的化学键( )
| A. | 一定是共价键 | B. | 一定是离子健 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 既含离子键又含共价键 |
2.下列分子为极性分子的是( )
| A. | BF3 | B. | NH3 | C. | SO3 | D. | CS2 |
3.下列有关元素的性质及其递变规律正确的是( )
| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |