题目内容
1.一定温度下,1molX和nmolY在体积为2L的密闭容器中发生如下反应:X(g)+2Y(g)?3Z(g)+W(s),10min后达到平衡,此时生成3amolZ.下列说法正确的是( )| A. | 用X表示此反应的反应速率时是0.1(1-a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到了平衡状态 | |
| C. | 向上述平衡体系中再充入1molX,v正增大,v逆减小,平衡正向移动 | |
| D. | 向平衡后的体系中加入1molW,平衡向逆反应方向移动 |
分析 A.利用物质的量变化量之比等于化学计量数之比计算X的物质的量变化量,再根据v=$\frac{\frac{△△}{V}}{△t}$计算;
B.随反应进行,反应混合气体的质量减小,混合气体的质量不变,说明到达平衡;
C.固体对化学反应速率和化学平衡都没有影响;
D.再充入1molX,反应物的浓度增大,生成物的浓度不变,所以v(正)增大,v(逆)不变,平衡向正反应移动.
解答 解:A.10min后达到平衡,生成3amolZ,则参加反应的X的物质的量为amol,故v(X)=$\frac{\frac{amol}{2L}}{10min}$=0.05amol/(L•min),故A错误;
B.随反应进行,反应混合气体的质量减小,混合气体的质量不变,说明到达平衡,故B正确;
C.D.向上述平衡体系中再充入1molX,反应物的浓度增大,生成物的浓度不变,所以v(正)增大,v(逆)不变,平衡向正反应移动,故C错误;
D.因固体和纯液体改变它的物质的量并不会改变它的浓度,因此化学平衡并不移动,故D错误;
故选B.
点评 本题主要考查了化学平衡的计算,题目难度中等,涉及化学反应速率的计算、化学平衡移动、化学平衡状态判断等,明确化学平衡及其影响因素为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
9.下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是( )
| A. | 钠与氧气反应 | B. | 盐酸和碳酸氢钠溶液 | ||
| C. | 铜与硝酸反应 | D. | 氯化铝溶液和氢氧化钠溶液反应 |
6.已知X和Y是短周期元素,现有Xn-和Ym+两种简单离子,已知Xn-比Ym+多两个电子层,则下列说法中正确的是( )
| A. | X只能位第三周期 | B. | Xn-一定有3个电子层 | ||
| C. | Y的原子序数不大于7 | D. | Y不可能位于第二周期 |
13.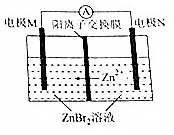 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )| A. | 放电时,电极N为正极 | |
| B. | 放电时.正极的电极反应式为Br2+2e-═2B- | |
| C. | 充电时,电极M与直流电源的负极相连 | |
| D. | 充电时,Zn2+通过离子交换膜从右向左迁移 |
17.下列叙述正确的是( )
| A. | 6.02×1023叫做阿伏加德罗常数 | |
| B. | 摩尔(mol)是国际单位制中七个基本单位之一 | |
| C. | 1mol气体的体积随压强和温度的增大而变小 | |
| D. | 气体摩尔体积(Vm)是指1 mol任何气体所占的体积都约为22.4 L |
 现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题:
现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题: