题目内容
11.某同学需要配制450mL 0.5mol•L-1的NaOH溶液.试回答下列问题:(1)完成本实验应选择500mL的容量瓶;
(2)配制需NaOH固体的质量为10.0g;
(3)在溶解过程中玻璃棒的作用是搅拌,加速溶解;
(4)转移、洗涤所配制的溶液.洗涤烧杯2~3次的目的是保证溶质全部转移至容量瓶中;
(5)在定容滴加蒸馏水时,若不慎超过了刻度线,则处理的方法是重新配制;
(6)判断下列情况对所配制溶液浓度的影响(填“偏大”、“偏小”、“无影响”)
A.洗净的容量瓶中残留有少量水无影响;
B.转移过程中所用的烧杯、玻璃棒未洗涤偏小;
C.定容时俯视液面偏大;
D.定容摇匀后发现液面低于刻度线又加入少许水调至刻度线偏小.
分析 (1)实验室没有450mL的容量瓶,需配制500mL;
(2)根据n=cV,m=nM计算;
(3)搅拌可以加快固体的溶解;
(4)转移溶液时,要把残留在烧杯中的溶质全部转入容量瓶;
(5)配制溶液时出现错误操作,要重新配制;
(6)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)某同学需要配制450mL 0.5mol•L-1的NaOH溶液,由于实验室没有450mL的容量瓶,所以要配制500mL溶液,则需要使用500mL的容量瓶,
故答案为:500;
(2)配制500mL 0.5mol•L-1的NaOH溶液,氢氧化钠的物质的量为n=cV=0.5L×0.5mol•L-1=0.25mol,m=nM=0.25mol×40g/mol=10.0g;
故答案为:10.0g;
(3)把氢氧化钠转入烧杯,再加水溶解,溶解时用玻璃棒搅拌可以加快固体的溶解;
故答案为:搅拌,加速溶解;
(4)把烧杯中的溶液转移到容量瓶时,烧杯中会有残留的氢氧化钠,为了保证溶质全部转移至容量瓶中,要洗涤烧杯2~3次,并把洗液转入容量瓶;
故答案为:保证溶质全部转移至容量瓶中;
(5)在定容滴加蒸馏水时,若不慎超过了刻度线,溶液的体积偏大,浓度偏小,要重新配制;
故答案为:重新配制;
(6)A.洗净的容量瓶中残留有少量水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故答案为:无影响;
B.转移过程中所用的烧杯、玻璃棒未洗涤,导致部分溶质损失,溶质的物质的量偏小,溶液浓度偏小,故答案为:偏小;
C.定容时俯视液面,导致溶液体积偏小,溶液浓度偏大,故答案为:偏大;
D.翻转摇匀后发现液面低于刻线又加入少许水调平,导致溶液体积偏大,溶液浓度偏小,故答案为:偏小.
点评 本题考查了配制一定物质的量浓度的溶液方法,明确配制原理及操作步骤是解题关键,注意依据C=$\frac{n}{V}$进行误差分析的方法,题目难度不大.

 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案| A. | Na2O、Na2O2为相同元素组成的金属氧化物,其中Na2O2不属于碱性氧化物 | |
| B. | SiO2是硅酸的酸酐,NO2是HNO3的酸酐 | |
| C. | Fe(OH)3与氢碘酸反应的类型为复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
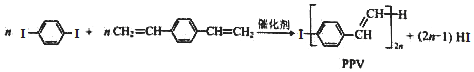
下列说法中正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | 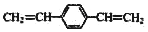 和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法可测定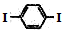 的相对分子质量 的相对分子质量 |
①CH3CH2CH2CH2CH3
②
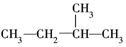
③
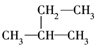
④
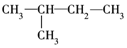
⑤
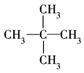
这些结构中出现重复的是( )
| A. | ②和③ | B. | ④和⑤ | C. | ③和⑤ | D. | 均不重复 |
| A. | 30mol | B. | 100mol | C. | 10mol | D. | 5mol |
| A. | 用X表示此反应的反应速率时是0.1(1-a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到了平衡状态 | |
| C. | 向上述平衡体系中再充入1molX,v正增大,v逆减小,平衡正向移动 | |
| D. | 向平衡后的体系中加入1molW,平衡向逆反应方向移动 |
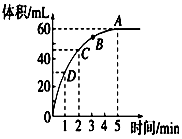 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g•mL-1),在标准状况下放出气体的体积和时间的关系如图所 示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g•mL-1),在标准状况下放出气体的体积和时间的关系如图所 示,回答下列问题:



