题目内容
12. 现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题:
现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题:(1)写出D的化学式CO2;
(2)B和D反应的化学方程式为2NaOH+CO2=Na2CO3+H2O;C和E反应的化学方程式为Fe+2HCl=FeCl2+H2↑;
(3)A和D反应生成一种常见的氧化物,该氧化物的名称是一氧化碳;
(4)上述反应中属于复分解反应的有2个,属于氧化还原反应的有2个.
分析 D属于酸性氧化物,应为CO2,能与二氧化碳反应的为碳、氢氧化钠溶液,由转化关系可知A为碳,B为NaOH,则E应为HCl,C为Fe,以此解答该题.
解答 解:(1)由以上分析可知D为二氧化碳,故答案为:CO2;
(2)B为NaOH,与二氧化碳反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2=Na2CO3+H2O,E为HCl,C为Fe,二者反应生成氯化亚铁和氢气,方程式为Fe+2HCl=FeCl2+H2↑,
故答案为:2NaOH+CO2=Na2CO3+H2O;Fe+2HCl=FeCl2+H2↑;
(3)碳和二氧化碳在加热条件下发生氧化还原反应生成一氧化碳,故答案为:一氧化碳;
(4)题目中有单质参加的反应为氧化还原反应,即碳和二氧化碳、铁和盐酸的反应为氧化还原反应,共2个,复分解反应涉及二氧化碳和氢氧化钠、氢氧化钠和盐酸的反应,共2个,故答案为:2;2.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力的考查,注意把握物质的性质以及反应的关系的判断,为解答该题的关键,难度不大.

练习册系列答案
相关题目
2.下列说法中,正确的是( )
| A. | Na2O、Na2O2为相同元素组成的金属氧化物,其中Na2O2不属于碱性氧化物 | |
| B. | SiO2是硅酸的酸酐,NO2是HNO3的酸酐 | |
| C. | Fe(OH)3与氢碘酸反应的类型为复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
3.下列式子是某学生书写的C5H12的同分异构体的结构简式
①CH3CH2CH2CH2CH3
②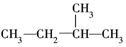
③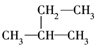
④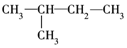
⑤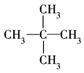
这些结构中出现重复的是( )
①CH3CH2CH2CH2CH3
②
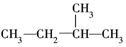
③

④
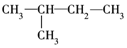
⑤

这些结构中出现重复的是( )
| A. | ②和③ | B. | ④和⑤ | C. | ③和⑤ | D. | 均不重复 |
20.0.1mol NaCl溶解在多少mol水中,才能使每100个水分子中含有一个Na+离子( )
| A. | 30mol | B. | 100mol | C. | 10mol | D. | 5mol |
17.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 实验 | 现象 | 结论 | |
| A | 将氯气通入装有湿润的红色布条的集气瓶 | 布条红色褪去 | HClO具有漂白性 |
| B | 将铜粉加入1.0mol•L-1的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活泼 |
| C | 用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比较低 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水蒸汽在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
4.现有四组液体:①氯化钠溶液和四氯化碳组成的混合液 ②乙醇水溶液 ③氯化钠和单质溴的水溶液 ④碳酸钙和氯化钙溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏、蒸发 | B. | 萃取、蒸馏、分液、过滤 | ||
| C. | 分液、蒸馏、萃取、过滤 | D. | 蒸馏、萃取、分液、过滤 |
1.一定温度下,1molX和nmolY在体积为2L的密闭容器中发生如下反应:X(g)+2Y(g)?3Z(g)+W(s),10min后达到平衡,此时生成3amolZ.下列说法正确的是( )
| A. | 用X表示此反应的反应速率时是0.1(1-a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到了平衡状态 | |
| C. | 向上述平衡体系中再充入1molX,v正增大,v逆减小,平衡正向移动 | |
| D. | 向平衡后的体系中加入1molW,平衡向逆反应方向移动 |
9.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g) $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g).按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如表:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω2 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ3 |
| A. | 2c1<1.5 | |
| B. | ρ1=ρ3 | |
| C. | ω2=2ω3 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3c-1.5)^{3}}$ |