题目内容
18.利用制磷肥的副产物氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如图1: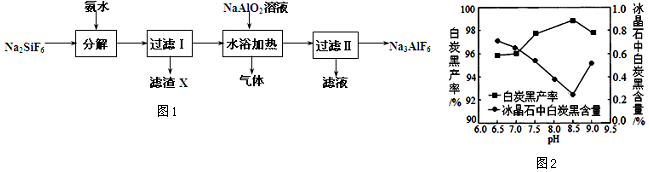
(1)分解过程发生的反应为:Na2SiF6+4NH3•H2O═2NaF+4NH4F+X↓+2H2O.工业上把滤渣X叫白炭黑,其化学式为SiO2.
(2)分解时白炭黑产率和冰晶石纯度与pH的关系如图2,分解时需要控制溶液的pH=8.5;能提高其分解速率的措施有A(填字母).
A.快速搅拌
B.加热混合液至100℃
C.减小氨水浓度
(3)流程中可循环利用的物质为NH3(NH3.H2O);冰晶石在电解冶炼铝中的作用降低氧化铝的熔融温度,减少能耗.
(4)水浴加热过程中生成冰晶石的化学方程式为2NaF+4NH4F+NaAlO2$\frac{\underline{\;水浴加热\;}}{\;}$Na3AlF6↓+4NH3↑+2H2O.
分析 (1)根据化学反应中原子守恒可得;
(2)溶液pH应满足冰晶石中白炭黑的含量较低为宜,加快反应速率可以快速搅拌,同时考虑氨气受热易分解不利于反应;
(3)第二次过滤所得,滤液为氨气水溶液,可循环使用;冰晶石降低氧化铝的熔融温度,减少能耗;
(4)水浴加热过程中氟化钠、氟化铵与偏铝酸钠生成冰晶石,氨气和水.
解答 解:(1)分解过程发生的反应为:Na2SiF6+4NH3•H2O═2NaF+4NH4F+X↓+2H2O,化学反应前后原子守恒,则X为SiO2;
故答案为:SiO2;
(2)从图可知,pH为8.5时,冰晶石中白炭黑的含量较低,冰晶石纯度较高;能提高其分解速率的措施有
A.快速搅拌可以加快反应速率,正确,B.加热混合液至100℃,氨水受热分解,反应物浓度小,化学反应速率减慢,错误,C.减小氨水浓度,化学反应速率减慢,故错误;
故答案为:8.5;A;
(3)第二次过滤所得,滤液为氨气水溶液,可循环使用;冰晶石降低氧化铝的熔融温度,减少能耗;
故答案为:NH3 (NH3.H2O);降低氧化铝的熔融温度,减少能耗;
(4)水浴加热过程中生成冰晶石的化学方程式为:2NaF+4NH4F+NaAlO2 $\frac{\underline{\;水浴加热\;}}{\;}$Na3AlF6↓+4NH3↑+2H2O;
故答案为:2NaF+4NH4F+NaAlO2 $\frac{\underline{\;水浴加热\;}}{\;}$Na3AlF6↓+4NH3↑+2H2O.
点评 本题考查化学工艺流程、无机物推断等,题目难度中等,理解工艺流程是解题的关键,题中物质的制备是中学中比较陌生的知识,是难点、易错点,需要学生基本扎实的据此与运用知识分析解决问题的能力.

练习册系列答案
相关题目
1.一定温度下,1molX和nmolY在体积为2L的密闭容器中发生如下反应:X(g)+2Y(g)?3Z(g)+W(s),10min后达到平衡,此时生成3amolZ.下列说法正确的是( )
| A. | 用X表示此反应的反应速率时是0.1(1-a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到了平衡状态 | |
| C. | 向上述平衡体系中再充入1molX,v正增大,v逆减小,平衡正向移动 | |
| D. | 向平衡后的体系中加入1molW,平衡向逆反应方向移动 |
9.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g) $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g).按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如表:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω2 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ3 |
| A. | 2c1<1.5 | |
| B. | ρ1=ρ3 | |
| C. | ω2=2ω3 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3c-1.5)^{3}}$ |
13.下列关于有机物因果关系的叙述中,完全正确的一组是( )
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳双键 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 纤维素和淀粉的化学式均为(C6H10O5)n | 它们属于同分异构体 |
| D | 乙酸乙酯和乙烯在一定条件下都能与水反应 | 二者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |
3.下列说法正确的是( )
| A. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 | |
| B. | 雷雨天气时空气中能生成少量的氮氧化物 | |
| C. | 铵盐易溶于水,化学性质稳定,受热不易分解 | |
| D. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 |
10.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应为吸热反应(选填“吸热”、“放热”).
(2)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(3)若 830℃时,向1L密闭容器中充入1mol CO、1mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”),平衡时,CO的浓度是0.5mol/L
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向 (选填“正反应方向”、“逆反应方向”、“不移动”)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(选填“吸热”、“放热”).
(2)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡不移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(3)若 830℃时,向1L密闭容器中充入1mol CO、1mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”),平衡时,CO的浓度是0.5mol/L
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向 (选填“正反应方向”、“逆反应方向”、“不移动”)
7.在常温常压下,已知:
①4Fe(s)+3O2(g)═2Fe2O3(s)△H1
②4Al(s)+3O2(g)═2Al2O3(s)△H2
③2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H3
则△H3与△H1、△H2之间的关系正确的是( )
①4Fe(s)+3O2(g)═2Fe2O3(s)△H1
②4Al(s)+3O2(g)═2Al2O3(s)△H2
③2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H3
则△H3与△H1、△H2之间的关系正确的是( )
| A. | △H3=$\frac{1}{2}$(△H1+△H2) | B. | △H3=△H2-△H1 | C. | △H3=2(△H1+△H2) | D. | △H3=$\frac{1}{2}$(△H2-△H1) |
8.下列电解质溶于水时的电离方程式中,书写正确的是( )
| A. | H2SO3?2H++SO32- | B. | NaHSO4=Na++H++SO42- | ||
| C. | NaHCO3=Na++H++CO32- | D. | K2SO4=K2++SO42- |