题目内容
 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.(1)此配合物中,铁离子的价电子排布式为
(2)此配离子中含有的作用力有
A.离子键 B.金属键 C.极性键 D.非极性键E.配位键 F.氢键 G.σ键 H.π键
(3)此配合物中碳原子的杂化轨道类型有
考点:原子核外电子排布,原子轨道杂化方式及杂化类型判断,不同晶体的结构微粒及微粒间作用力的区别
专题:
分析:(1)铁元素是26号元素,铁原子核外有26个电子,根据构造原理知其基态原子核外电子排布式,铁原子失去3个电子变为铁离子,铁离子核外有23个电子,3d电子为其价电子;
(2)同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键;
(3)根据价层电子对互斥理论确定其杂化类型.
(2)同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键;
(3)根据价层电子对互斥理论确定其杂化类型.
解答:
解:(1)铁元素是26号元素,铁原子核外有26个电子,根据构造原理知其基态原子核外电子排布式,铁原子失去3个电子变为铁离子,铁离子核外有23个电子,3d电子为其价电子,铁离子3d能级上有5个电子,4s能级上没有电子,所以其价电子排布式为:3d5,故答案为:3d5;
(2)同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键,所以该化合物中碳碳原子之间存在非极性共价键,碳和氧原子或氢原子之间存在极性共价键,铁离子和氧原子之间存在配位键,则该化合物中含有配位键、极性键、非极性键、σ键和π键,故选CDEGH;
(3)该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化,故答案为:sp2、sp3.
(2)同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键,所以该化合物中碳碳原子之间存在非极性共价键,碳和氧原子或氢原子之间存在极性共价键,铁离子和氧原子之间存在配位键,则该化合物中含有配位键、极性键、非极性键、σ键和π键,故选CDEGH;
(3)该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化,故答案为:sp2、sp3.
点评:本题考查了元素的推断、价电子排布式的书写、分子构型的判断等知识点,明确哪些元素之间易形成配位键、哪些元素之间易形成极性共价键或非极性共价键,会利用知识迁移的方法分析问题,难度较大.

练习册系列答案
相关题目
用一定量的NH4NO3和KH2PO4的固体混合物可以配制无土栽培营养液,已知固体混合物中氮元素的质量分数为28%,则固体混合物中KH2PO4的质量分数为( )
| A、20% | B、25% |
| C、80% | D、85% |
在常温条件下,下列对醋酸的叙述中,不正确的是( )
| A、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | ||
B、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| C、浓度均为0.1mol?L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | ||
| D、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A、欲增大平衡状态时c(CH3OH)/c(CO2)的比值,可采用升高温度的方法 |
| B、3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同 |
| C、欲提高H2的平衡转化率只能减小反应容器的体积 |
| D、从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025 mol?L-1?min-1 |
2013年1月,我国中东部的大部分地区出现雾霾天气,许多城市的空气质量已经达到了严重污染.下列有关说法中,正确的是( )
| A、雾霾天气仅影响出行能见度,对人体健康没有影响 |
| B、减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施 |
| C、当光束分别通过雾霾和豆浆时,仅豆浆可看到一条光亮的“通路” |
| D、气候环境报告中新增的“PM2.5”就是雾霾 |
下列关系与共价键键能无关的是( )
| A、热稳定性:HCl>HBr |
| B、熔沸点:SiO2>SiC |
| C、熔沸点:C12>F2 |
| D、熔沸点:金刚石>单晶硅 |
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、常温下浓硫酸与铝不反应,可用铝槽车运输 |
C、二氧化碳的电子式: |
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
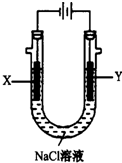 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.