题目内容
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、常温下浓硫酸与铝不反应,可用铝槽车运输 |
C、二氧化碳的电子式: |
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
考点:反应热和焓变,电子式,难溶电解质的溶解平衡及沉淀转化的本质,浓硫酸的性质
专题:
分析:A、根据本反应前后气体变固体,熵变小于零,只有在焓变小于零时自发;
B、常温下铝在浓硫酸中发生钝化;
C、二氧化碳的电子式: ;
;
D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,但两者反应生成了NaOH,溶液的pH增大.
B、常温下铝在浓硫酸中发生钝化;
C、二氧化碳的电子式:
 ;
;D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,但两者反应生成了NaOH,溶液的pH增大.
解答:
解:A、本反应前后气体变固体,熵变小于零,只有在焓变小于零时自发,即该反应的△H<0,故A正确;
B、常温下铝在浓硫酸中发生钝化,故B错误;
C、二氧化碳的电子式: ,故C错误;
,故C错误;
D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,但两者反应生成了NaOH,溶液的pH增大,故D错误;
故选A.
B、常温下铝在浓硫酸中发生钝化,故B错误;
C、二氧化碳的电子式:
 ,故C错误;
,故C错误;D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,但两者反应生成了NaOH,溶液的pH增大,故D错误;
故选A.
点评:本题是化学反应与热效应、盐类的水解等的简单综合题,着力考查学生对用熵变焓变判断反应方向,水解反应等方面的能力.

练习册系列答案
相关题目
如图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是( )

| A、进入烟囱的气体为纯净物 |
| B、此过程中硫元素的化合价没有发生改变 |
| C、使用此废气处理装置可减少酸雨的形成 |
| D、整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2 |
下列说法中,正确的是( )
| A、强电解质溶液的导电性比弱电解质溶液的导电性强 |
| B、构成原子核的微粒中都含有中子 |
| C、在原电池中,物质在负极发生氧化反应 |
| D、对于任何反应来说,升高温度、增大压强、加入催化剂都可加快反应速率 |
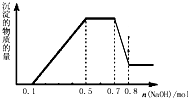 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
下列化学用语或模型表示正确的是( )
A、硝基苯的结构简式: |
B、COCl2分子的电子式: |
C、过氧化氢的电子式: |
D、NaCl的晶体模型: |
金属钒被誉为“合金的维生素”.五氧化二钒(V2O5)中钒元素的化合价为( )
| A、-3 | B、+1 | C、+3 | D、+5 |
下列反应的离子方程式不正确的是( )
| A、铁与氯化铁溶液:2Fe3++Fe═3Fe2+ |
| B、氯气与溴化钠溶液:2Br-+Cl2═Br2+2Cl- |
| C、硫酸铵和氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
| D、铜与稀硝酸:3Cu+8H++2NO3-═Cu2++2NO↑+4H2O |
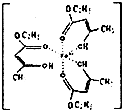 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.

