题目内容
在常温条件下,下列对醋酸的叙述中,不正确的是( )
| A、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | ||
B、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| C、浓度均为0.1mol?L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | ||
| D、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.根据电荷守恒分析;
B.加水稀释促进电离;
C.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+);
D.醋酸部分电离,醋酸的浓度大于氢离子的浓度,氢氧化钠的浓度等氢氧根离子的浓度.
B.加水稀释促进电离;
C.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+);
D.醋酸部分电离,醋酸的浓度大于氢离子的浓度,氢氧化钠的浓度等氢氧根离子的浓度.
解答:
解:A.pH=5.6的CH3COOH与CH3COONa混合溶液中,电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),pH=5.6,则c(H+>(OH-),所以c(Na+)<c(CH3COO-),故A正确;
B.加水稀释促进电离,则氢离子的物质的量增大,醋酸的物质的量减小,
=
变小,故B正确;
C.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故C正确;
D.pH=a的醋酸与pH=b的NaOH溶液恰好中和,醋酸和氢氧化钠的物质的量相等,醋酸为弱酸醋酸部分电离,醋酸的浓度大于氢离子的浓度,即c(CH3COOH)>10-amol/L,氢氧化钠的浓度等氢氧根离子的浓度,即c(NaOH)=10b-14mol/L,c(CH3COOH)=c(NaOH)=10b-14mol/L>10-amol,则a+b>14,故D错误;
故选D.
B.加水稀释促进电离,则氢离子的物质的量增大,醋酸的物质的量减小,
| c(CH3COOH) |
| c(H+) |
| n(CH3COOH) |
| n(H+) |
C.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故C正确;
D.pH=a的醋酸与pH=b的NaOH溶液恰好中和,醋酸和氢氧化钠的物质的量相等,醋酸为弱酸醋酸部分电离,醋酸的浓度大于氢离子的浓度,即c(CH3COOH)>10-amol/L,氢氧化钠的浓度等氢氧根离子的浓度,即c(NaOH)=10b-14mol/L,c(CH3COOH)=c(NaOH)=10b-14mol/L>10-amol,则a+b>14,故D错误;
故选D.
点评:本题考查弱电解质的电离,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点以及影响因素,题目难度中等.

练习册系列答案
相关题目
下图所示的实验,能达到实验目的是[( )
A、 验证化学能转化为电能 |
B、 验证温度对平衡移动的影响 |
C、 验证铁发生析氢腐蚀 |
D、 验证非金属Cl>C>Si |
如图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是( )

| A、进入烟囱的气体为纯净物 |
| B、此过程中硫元素的化合价没有发生改变 |
| C、使用此废气处理装置可减少酸雨的形成 |
| D、整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2 |
常温下,0.1mol?L-1的一元酸HA与0.1mol?L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是( )
| A、混合前一元酸HA的c(H+)=0.1 mol?L-1 |
| B、该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、HA在水溶液中的电离方程式:HA=H++A- |
| D、该混合溶液中:c(A-)+c(HA)=0.1 mol?L-1 |
25℃时,0.1mol?L-1下列溶液的pH如下表,有关比较错误的是( )
| 序 号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A、酸的强度:HF>H2CO3 |
| B、由水电离产生的c(H+):①=② |
| C、溶液中离子的总浓度:①>③ |
| D、④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=1mol?L-1 |
金属钒被誉为“合金的维生素”.五氧化二钒(V2O5)中钒元素的化合价为( )
| A、-3 | B、+1 | C、+3 | D、+5 |




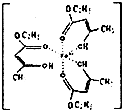 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.