题目内容
下列关系与共价键键能无关的是( )
| A、热稳定性:HCl>HBr |
| B、熔沸点:SiO2>SiC |
| C、熔沸点:C12>F2 |
| D、熔沸点:金刚石>单晶硅 |
考点:共价键的形成及共价键的主要类型,元素周期律的作用
专题:
分析:A.元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定;
B.原子晶体中,键长越短,键能越大,物质的熔点、沸点越高;
C.组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,沸点越高;
D.原子晶体中,键长越短,键能越大,物质的熔点、沸点越高.
B.原子晶体中,键长越短,键能越大,物质的熔点、沸点越高;
C.组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,沸点越高;
D.原子晶体中,键长越短,键能越大,物质的熔点、沸点越高.
解答:
解:A.非金属性:Cl>Br,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,与共价键有关,故A错误;
B.SiO2、SiC都属于原子晶体,SiO2中硅氧键的键长小于SiC中碳硅键的键长,所以熔沸点:SiO2>SiC,与共价键有关,故B错误;
C.F2、Cl2属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键的键能大小无关,故C正确;
D.金刚石、晶体硅都属于原子晶体,金刚石中碳碳键的键长小于晶体硅中硅硅键的键长,所以金刚石的硬度、熔点、沸点都高于晶体硅,与共价键有关,故D错误;
故选C.
B.SiO2、SiC都属于原子晶体,SiO2中硅氧键的键长小于SiC中碳硅键的键长,所以熔沸点:SiO2>SiC,与共价键有关,故B错误;
C.F2、Cl2属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键的键能大小无关,故C正确;
D.金刚石、晶体硅都属于原子晶体,金刚石中碳碳键的键长小于晶体硅中硅硅键的键长,所以金刚石的硬度、熔点、沸点都高于晶体硅,与共价键有关,故D错误;
故选C.
点评:本题考查晶体的熔沸点的比较,分子的稳定性,题目难度不大,注意晶体的类型以及影响晶体熔沸点高低的因素的判断.

练习册系列答案
相关题目
下图所示的实验,能达到实验目的是[( )
A、 验证化学能转化为电能 |
B、 验证温度对平衡移动的影响 |
C、 验证铁发生析氢腐蚀 |
D、 验证非金属Cl>C>Si |
下列说法正确的是( )
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
下列说法中,正确的是( )
| A、强电解质溶液的导电性比弱电解质溶液的导电性强 |
| B、构成原子核的微粒中都含有中子 |
| C、在原电池中,物质在负极发生氧化反应 |
| D、对于任何反应来说,升高温度、增大压强、加入催化剂都可加快反应速率 |
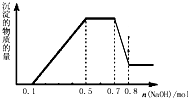 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
金属钒被誉为“合金的维生素”.五氧化二钒(V2O5)中钒元素的化合价为( )
| A、-3 | B、+1 | C、+3 | D、+5 |
影响化学反应速率的因素有多方面,如浓度.压强.温度.催化剂等.下列有关说法不正确的是( )
| A、改变压强能改变气体反应的速率 |
| B、增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C、温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D、催化剂能加快化学反应速率主要原因是降低反应所需的能量 |

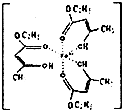 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.