题目内容
5.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| C. | 1L0.1mol/LCuCl2溶液中含有Cu2+离子数小于0.1NA | |
| D. | 1mol/L醋酸溶液中含有的H+离子数小于NA |
分析 A.二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底;
B.四氧化二氮与二氧化氮存在转化平衡,导致气体分子数减小;
C.铜离子易发生水解;
D.溶液的体积不确定.
解答 解:A.二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底,0.2molSO2和0.1molO2在一定条件下,充分反应生成SO3的分子数小于0.4NA ,故A错误;
B.标准状况下,22.4LNO的物质的量为1mol、11.2L O2的物质的量为0.5mol,二者反应后生成了1mol二氧化氮,由于二氧化氮与四氧化二氮存在转化平衡,所以反应后混合气体的物质的量小于1mol,混合后气体的分子总数小于NA,故B错误;
C.铜离子易发生水解,Cu2+离子数小于0.1NA,故C正确;
D.溶液的体积不确定,H+离子数可能大于NA,故D错误.
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下三氧化硫不是气体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,B为易错点,注意明确二氧化氮与四氧化二氮之间的转化平衡.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
15.下列有机物中能与NaOH溶液发生反应的是( )
①甲苯 ②乙酸 ③乙醇 ④乙酸乙酯 ⑤油脂.
①甲苯 ②乙酸 ③乙醇 ④乙酸乙酯 ⑤油脂.
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
16.下列说法正确的是( )
| A. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
13.若mg Na在足量氯气中燃烧,生成固体的质量为(m+3.55g),则mg Na与氧气反应,生成固体的质量为 ( ) ①(m+0.8g) ②(m+1.0g) ③(m+1.2g) ④(m+1.6g) ⑤(m+1.4g)
| A. | ①②④ | B. | ①⑤ | C. | ③④ | D. | ①②③④⑤ |
20.将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )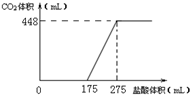

| A. | HCl的浓度0.2mol/L | |
| B. | 反应后固体的成分为NaOH与Na2CO3 | |
| C. | 密闭容器中排出气体的成分为O2和H2O | |
| D. | x的数值为6.09 |
10.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系正确的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊,继续通入CO2至过量,溶液变澄清 | BaCl2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色退去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,无明显变化 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
17.以0.10mol/L的氢氧化钠溶液滴定某一元酸HA的滴定曲线如图所示.下列表述正确的是( )
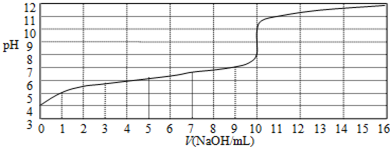

| A. | 此实验可以选用甲基橙作指示剂 | |
| B. | 该酸HA的浓度约为1×10-4mol/L | |
| C. | 当NaOH体积为9 mL时,恰好完全中和反应 | |
| D. | 达到滴定终点时,溶液中c(Na+)>c (A-) |
15.下列说法中,正确的是( )
| A. | 甲醛、乙醛、丙醛通常情况下都是液体 | |
| B. | 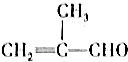 是乙醛的同系物 是乙醛的同系物 | |
| C. | 可用浓盐酸洗去银镜反应实验生成的银镜 | |
| D. | 1mol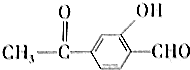 最多能与5mol H2发生反应 最多能与5mol H2发生反应 |