题目内容
20.将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )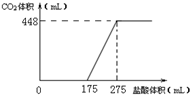
| A. | HCl的浓度0.2mol/L | |
| B. | 反应后固体的成分为NaOH与Na2CO3 | |
| C. | 密闭容器中排出气体的成分为O2和H2O | |
| D. | x的数值为6.09 |
分析 在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,根据二者的物质的量的关系来分析求解.
解答 解:A、由175ml到275ml是与碳酸氢钠反应,而n(Na2CO3)=n(NaHCO3)=n(CO2)=0.02mol,
NaHCO3~~~HCl
1mol 1mol
0.02mol 0.02mol
所以C(HCl)=$\frac{0.02mol}{(275-175)×1{0}^{-3}L}$=0.2mol/L,故A正确;
B、由图象可知,因为175>275-175所以固体混,合物为NaOH,Na2CO3,故B正确;
C、由方程式可知:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,生成0.02mol的二氧化碳和0.02mol的水,再根据2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑可知密闭容器中排出气体的成分O2,H2O,故C正确;
D、根据碳守恒可知,n(NaHCO3)=n(CO2)=0.02mol=0.02mol,275ml时溶质是单一的氯化钠,根据钠守恒可知n(Na2O2)=$\frac{0.2mol/L×0.275L-0.02mol}{2}$=0.0175mol,固体的质量为:0.02×84+0.0175×78=3.045g,故x=3.045g,故D错误;
故选D.
点评 本题考查了过氧化钠、碳酸氢钠的性质及混合物组成的计算,题目难度中等,注意掌握过氧化钠、碳酸氢钠的性质及根据化学方程式进行的简单计算方法,本题中分析、理解图象信息是解题关键.

 习题精选系列答案
习题精选系列答案| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH最大的是① | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
| A. | 铁有良好的导热性,常用来制作炊具 | |
| B. | 铜的化学性质不活泼,因此可用于制导线 | |
| C. | 废旧电池中汞的回收可减少对环境的污染 | |
| D. | 钛合金与人体有很好的“相容性,因此可用来制造人造骨 |
| A. | 1s | B. | 3s | C. | 10s | D. | 30s |
| A. | 某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| C. | 1L0.1mol/LCuCl2溶液中含有Cu2+离子数小于0.1NA | |
| D. | 1mol/L醋酸溶液中含有的H+离子数小于NA |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 甲基橙呈红色的溶液中:Fe2+、Cl-、NO3-、Na+ | |
| B. | 石蕊呈蓝色的溶液中:K+、AlO2-、SiO32-、HSO3- | |
| C. | 含大量Al3+的溶液中:K+、Ca2+、NO3-、HCO3- | |
| D. | 含大量OH一的溶液中:CO32-、ClO3-、F-、K+ |
| A. | 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 氯水属于混合物,而液氨、冰醋酸均属于纯净物 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |