题目内容
3.下列有关电化学的图示,完全正确的是( )| A. | 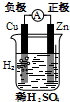 Cu-Zn原电池 | B. | 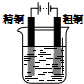 CuSO4溶液粗铜的精炼 | ||
| C. |  NnCl2溶液铁片镀锌 | D. | 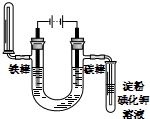 饱和NaCl溶液验证气体产物 |
分析 A.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极;
B.粗铜的精炼中,粗铜作阳极,纯铜作阴极;
C.电镀时,镀层作阳极,镀件作阴极;
D.电解时,电流流入的电极为阳极,另一电极为阴极,阳极上发生氧化反应,阴极上发生还原反应.
解答 解:A.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,所以铜-锌-稀硫酸原电池中,锌作负极,铜作正极,故A错误;
B.粗铜的精炼中,粗铜作阳极,纯铜作阴极,电解质溶液为含有铜离子的盐,故B错误;
C.该装置是电镀,在铁片上镀锌,应该把镀件Fe片作阴极,把Zn片作阳极,含有Zn2+的溶液作电镀溶液,金属片与电源的连接,故C错误;
D.电解时,电流流入的电极为阳极,另一电极为阴极,所以电解氯化钠溶液时,根据图片知,碳棒为阳极,铁棒为阴极,阳极上氯离子失电子生成氯气,氯气能置换碘化钾中的碘,碘遇淀粉变蓝色,所以阳极上用淀粉碘化钾溶液可检验氯气的存在;阴极上氢离子得电子生成氢气,利用氢气的燃烧实验检验阴极产物;溶液中有氢氧化钠产生,无色酚酞试液遇碱变红色,所以可用无色酚酞检验氢氧化钠的生成,故D正确;
故选D.
点评 本题考查了原电池原理、电解原理、电镀等知识点,难度不大,注意:电镀时,镀层作阳极,镀件作阴极.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),达到平衡时,测的A的浓度为0.5mol/L,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测的A的浓度降低为0.3mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
14.对下图有机物的命名正确的是( )
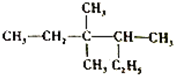

| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
18.下列化学事实的描述或解释正确的是( )
| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化学反应既属于复分解反应又属于氧化还原反应 | |
| D. | 常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,可能生成了弱酸强碱盐 |
8.下列粒子半径之比大于1的是( )
| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |
15.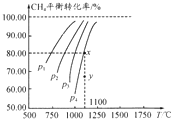 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | 压强P1>P2>P3>P4 | |
| C. | 1100℃时该反应的平衡常数约为1.64 | |
| D. | 压强为P4时,y点的v正<v逆 |
12.黑火药在适当的外界能量作用下,能进行迅速而有规律的燃烧,瞬间产生大量的热和氮气、二氧化碳等气体,由干体积急剧膨胀,压力猛烈增大,于是发生了爆炸.反应方程式为S+2KNO3+3C=K2S+N2↑+3CO2↑,下列说法错误的是( )
| A. | C在反应中被还原 | B. | S和KNO3都发生了还原反应 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
13.下列鉴别物质的方法能达到目的是( )
| A. | 用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液 | |
| B. | 用稀硫酸鉴别碳酸钠固体和碳酸钾固体 | |
| C. | 用湿润的蓝色石蕊试纸鉴别氨气和氢气 | |
| D. | 用淀汾溶液鉴别加碘盐(含KI03)和未加碘盐 |
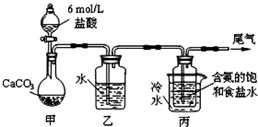 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.