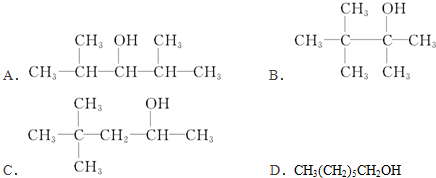题目内容
18.下列化学事实的描述或解释正确的是( )| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化学反应既属于复分解反应又属于氧化还原反应 | |
| D. | 常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,可能生成了弱酸强碱盐 |
分析 A.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
B.NH4HCO3溶于过量的NaOH溶液中,铵根离子和碳酸氢根离子都和氢氧根离子反应;
C.复分解反应中没有电子转移,有电子转移的化学反应是氧化还原反应;
D.常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,说明酸浓度小于碱浓度.
解答 解:A.根据溶液中的质子守恒知Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-),故A正确;
B.NH4HCO3溶于过量的NaOH溶液,漏掉氢氧根离子与铵离子之间的反应,离子方程式为NH4++HCO3-+2OH-═CO32-+H2O+NH3.H2O,故B错误;
C.复分解反应中没有电子转移,有电子转移的化学反应是氧化还原反应,复分解反应一定不属于氧化还原反应,故C错误;
D.常温下,将pH=3的HA和pH=11的BOH等体积混合后PH>7,则酸为强酸,碱为弱碱,应生成强酸弱碱盐,故D错误;
故选A.
点评 本题考查溶液中的离子反应、离子方程式正误判断、氧化还原与四种基本反应类型的关系等知识,侧重考查学生分析判断能力,注意B中离子反应先后顺序及产物成分,为易错点.

练习册系列答案
相关题目
9.浓硫酸与下列物质作用时,既表现氧化性,又表现酸性的是( )
①炽热的木炭 ②H2S气体 ③Cu ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4•5H2O ⑧铁、铝.
①炽热的木炭 ②H2S气体 ③Cu ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4•5H2O ⑧铁、铝.
| A. | ③④ | B. | ①②⑤⑧ | C. | ①②③④⑦ | D. | ⑥⑦ |
3.下列有关电化学的图示,完全正确的是( )
| A. | 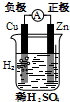 Cu-Zn原电池 | B. |  CuSO4溶液粗铜的精炼 | ||
| C. |  NnCl2溶液铁片镀锌 | D. |  饱和NaCl溶液验证气体产物 |
10.下列实验“操作和现象”与“结论”都正确的是( )
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
8.经质谱法测定,某烃W的相对分子质量为70.在W中滴加酸性高锰酸钾溶液,振荡,溶液褪色,下列有关W的说法正确的是( )
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
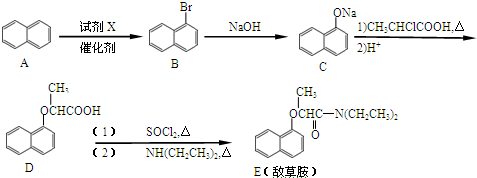
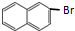 .
.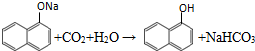 ;
;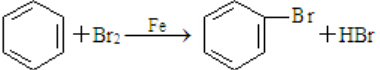 、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.