题目内容
下列A、B、C、D是中学常见的实验装置

请根据实验需要将A、B、C、D填入适当的空格中.
①分离汽油和氯化钠溶液
②用自来水制取蒸馏水
③除去粗盐溶液中悬浮的泥沙
④配制0.5mol/L Na2CO3溶液 .

请根据实验需要将A、B、C、D填入适当的空格中.
①分离汽油和氯化钠溶液
②用自来水制取蒸馏水
③除去粗盐溶液中悬浮的泥沙
④配制0.5mol/L Na2CO3溶液
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:①汽油和氯化钠溶液,分层,汽油在上层;
②自来水中水的沸点较低;
③粗盐溶液中,悬浮的泥沙不溶于水;
④配制0.5mol/L Na2CO3溶液,需要容量瓶、玻璃棒等仪器.
②自来水中水的沸点较低;
③粗盐溶液中,悬浮的泥沙不溶于水;
④配制0.5mol/L Na2CO3溶液,需要容量瓶、玻璃棒等仪器.
解答:
解:①汽油和氯化钠溶液,分层,汽油在上层,则分离方法为分液,即选择装置C,故答案为:C;
②自来水中水的沸点较低,则制备蒸馏水选择蒸馏法,即装置D,故答案为:D;
③粗盐溶液中,悬浮的泥沙不溶于水,则选择过滤法分离,即装置A,故答案为:A;
④配制0.5mol/L Na2CO3溶液,需要容量瓶、玻璃棒等仪器,则选择装置B,故答案为:B.
②自来水中水的沸点较低,则制备蒸馏水选择蒸馏法,即装置D,故答案为:D;
③粗盐溶液中,悬浮的泥沙不溶于水,则选择过滤法分离,即装置A,故答案为:A;
④配制0.5mol/L Na2CO3溶液,需要容量瓶、玻璃棒等仪器,则选择装置B,故答案为:B.
点评:本题考查混合物分离提纯方法,为高频考点,把握物质的性质、性质差异及混合物分离原理等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
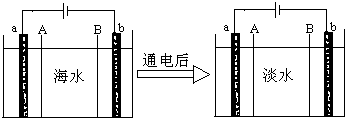 电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A、通电后,海水中阳离子往a电极处运动 |
| B、B膜是阴离子交换膜 |
| C、通电后,电子由b极经过溶液到达a极 |
| D、通电后,b电极上产生无色气体,溶液中少量白色沉淀 |
PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于5min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g)有关数据如下下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A、若升高温度,反应的平衡常数减小,则正反应为吸热 |
| B、反应5min内,v(PCl3)=0.08 mol?L-1?min-1 |
| C、当容器中Cl2为1.2mol时,可逆反应达到平衡状态 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol?L-1 |
下列除去杂质的方法,正确的是( )
| A、除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离 |
| B、除去乙醇中少量乙酸:加入碳酸钠溶液,分液 |
| C、除去FeCl3溶液中少量的CuCl2:加入过量铁粉,过滤 |
| D、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液 |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:下列说法中,正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、向氯水中加入少量NaHCO3可以增大氯水中次氯酸的浓度 |
| D、NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |