题目内容
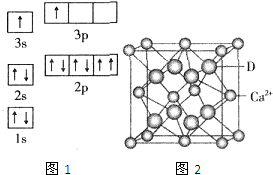 已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:(1)已知短周期元素A、B原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
②ACl2分子中A的杂化类型为
(2)已知C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱.D是周期表中电负性最大的元素.E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物.请根据上述信息,
①写出E元素原子基态时的电子排布式
②以C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为
③D与Ca2+可形成离子化合物,其晶胞结构如图2所示.其中Ca2+离子的配位数为
考点:晶胞的计算,位置结构性质的相互关系应用
专题:
分析:(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,3s能级能量比3p能级低,每个轨道最多只能容纳两个电子,且自旋相反配对,2p能级的轨道内有自旋方向相同的2个电子;
由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型;
(2)C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱,推知C为Al,D是周期表中电负性最大的元素,推知D为F,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,推知E为Cu.
①E为铜元素,是29号元素,根据构造原理书写电子排布式;
②铝与氢氧化钠溶液反应,故铝为负极,Al放电,在碱性条件下生成偏铝酸根与水;
③根据晶胞结构可知,每个Ca2+周围有4个F-,根据均摊法计算晶胞中Ca2+、F-数目,结合摩尔质量计算晶胞质量,在根据V=
计算晶胞体积.
由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型;
(2)C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱,推知C为Al,D是周期表中电负性最大的元素,推知D为F,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,推知E为Cu.
①E为铜元素,是29号元素,根据构造原理书写电子排布式;
②铝与氢氧化钠溶液反应,故铝为负极,Al放电,在碱性条件下生成偏铝酸根与水;
③根据晶胞结构可知,每个Ca2+周围有4个F-,根据均摊法计算晶胞中Ca2+、F-数目,结合摩尔质量计算晶胞质量,在根据V=
| m |
| ρ |
解答:
解:(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理与泡利原理.由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中S区,
故答案为:能量最低原理、泡利原理;S;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:SP;直线型;
(2)C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱,推知C为Al,D是周期表中电负性最大的元素,推知D为F,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,推知E为Cu,
①E为Cu,是29号元素,根据构造原理可知,铜元素原子基态时的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
②铝与氢氧化钠溶液反应,故铝为负极,Al放电,在碱性条件下生成偏铝酸根离子与水,电极反应式为Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
③根据晶胞结构可知,每个F-的配位数为4,则Ca2+配位数为8,晶胞中Ca2+数目=8×
+6×
=4,F-数目为8,晶胞的质量为4×
g,该晶体的密度为a g/cm3,则晶胞的体积=
=
g/m3,
故答案为:8;
.
故答案为:能量最低原理、泡利原理;S;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:SP;直线型;
(2)C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱,推知C为Al,D是周期表中电负性最大的元素,推知D为F,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,推知E为Cu,
①E为Cu,是29号元素,根据构造原理可知,铜元素原子基态时的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
②铝与氢氧化钠溶液反应,故铝为负极,Al放电,在碱性条件下生成偏铝酸根离子与水,电极反应式为Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
③根据晶胞结构可知,每个F-的配位数为4,则Ca2+配位数为8,晶胞中Ca2+数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 78 |
| NA |
| ||
| ag/cm3 |
| 4×78 |
| aNA |
故答案为:8;
| 4×78 |
| aNA |
点评:本题以元素的推断为载体,考查了核外电子排布式、晶胞的有关计算等知识点,确定钙离子配位数是难点,结合氟离子配位数与化学式解答,难度中等.

练习册系列答案
相关题目
下列除去杂质的方法,正确的是( )
| A、除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离 |
| B、除去乙醇中少量乙酸:加入碳酸钠溶液,分液 |
| C、除去FeCl3溶液中少量的CuCl2:加入过量铁粉,过滤 |
| D、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液 |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
| A、未洗涤烧杯和玻璃棒 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、定容时俯视液面 |
关于某有机物的性质叙述正确的是( )
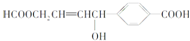
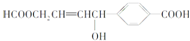
| A、1 mol该有机物可以与3 mol Na发生反应 |
| B、1 mol该有机物可以与3 mol NaOH发生反应 |
| C、1 mol该有机物可以与6 mol H2发生加成反应 |
| D、1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |