题目内容
铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO?xFe2O3的铝灰制备Al2(SO4)3?18H2O,工艺流程如下:
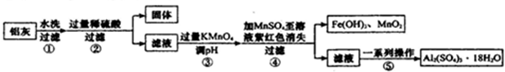
请回答下列问题:
(1)加入过量稀硫酸溶液溶解Al2O3的离子方程式是 .
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2,则发生反应的化学方程式为 .
(3)已知浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是 .若在该浓度下除去铁的化合物,调节pH值的范围是 .
(4)操作④的作用是 ;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是 .
(5)在操作⑤的“一系列操作”中,下列仪器不需要的是 (填序号).
A、蒸发皿 B、坩埚 C、玻璃棒 D、酒精灯 E、漏斗.

请回答下列问题:
(1)加入过量稀硫酸溶液溶解Al2O3的离子方程式是
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2,则发生反应的化学方程式为
(3)已知浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| 物质 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)操作④的作用是
(5)在操作⑤的“一系列操作”中,下列仪器不需要的是
A、蒸发皿 B、坩埚 C、玻璃棒 D、酒精灯 E、漏斗.
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:铝灰水洗过滤除去不溶性杂质SiO2,加入过量稀硫酸酸溶过滤,得到滤液中含有Al3+、Fe3+、Fe2+,加入高锰酸钾溶液调节溶液PH氧化亚铁离子为铁离子,加入MnSO4和过量的高锰酸钾溶液反应生成二氧化锰沉淀,过滤得到滤液中主要是铝离子,经过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铝晶体;
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
(4)操作④的作用是利用硫酸锰和高锰酸钾反应生成二氧化锰沉淀除去;为了验证该操作所得固体中确实含有MnO2,加入浓盐酸是否溶解生成 黄绿色气体检验;
(5)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作风分析所需仪器;
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
(4)操作④的作用是利用硫酸锰和高锰酸钾反应生成二氧化锰沉淀除去;为了验证该操作所得固体中确实含有MnO2,加入浓盐酸是否溶解生成 黄绿色气体检验;
(5)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作风分析所需仪器;
解答:
解:铝灰水洗过滤除去不溶性杂质SiO2,加入过量稀硫酸酸溶过滤,得到滤液中含有Al3+、Fe3+、Fe2+,加入高锰酸钾溶液调节溶液PH氧化亚铁离子为铁离子,加入MnSO4和过量的高锰酸钾溶液反应生成二氧化锰沉淀,过滤得到滤液中主要是铝离子,经过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铝晶体;
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水,反应的离子方程式为:6H++Al2O3=2Al3++3H2O;
故答案为::6H++Al2O3=2Al3++3H2O;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;
故答案为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
故答案为:亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,2.8≤PH<3.4;
(4)操作④的作用是利用硫酸锰和高锰酸钾反应生成二氧化锰沉淀除去;为了验证该操作所得固体中确实含有MnO2,加入浓盐酸是否溶解生成 黄绿色气体检验;
故答案为:剩余的MnO4-和Mn2+反应生成MnO2沉淀除去,浓盐酸;
(5)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作分析所需仪器为蒸发皿,玻璃棒、酒精灯、漏斗,坩埚是给固体加热 的仪器,不需要坩埚;
故答案为:B.
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水,反应的离子方程式为:6H++Al2O3=2Al3++3H2O;
故答案为::6H++Al2O3=2Al3++3H2O;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;
故答案为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
故答案为:亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,2.8≤PH<3.4;
(4)操作④的作用是利用硫酸锰和高锰酸钾反应生成二氧化锰沉淀除去;为了验证该操作所得固体中确实含有MnO2,加入浓盐酸是否溶解生成 黄绿色气体检验;
故答案为:剩余的MnO4-和Mn2+反应生成MnO2沉淀除去,浓盐酸;
(5)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作分析所需仪器为蒸发皿,玻璃棒、酒精灯、漏斗,坩埚是给固体加热 的仪器,不需要坩埚;
故答案为:B.
点评:本题考查了金属化合物的性质,离子方程式书写,溶度积常数的应用及其实验仪器的选择,分析流程掌握物质选择和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
钢铁发生腐蚀时,正极上发生的反应是( )
| A、2Fe-4e-=2Fe2+ |
| B、2Fe2++4e-=2Fe |
| C、2H2O+O2+4e-=4OH- |
| D、Fe3++e-=Fe2+ |
由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种.在此晶体中,氧离子和超氧离子的物质的量之比为( )
| A、2:1 | B、1:2 |
| C、1:1 | D、1:3 |
下列各组物质中,第一种是酸,第二种是碱,第三种是的是混合物( )
| A、硫酸、CuSO4?5H2O、苛性钾 |
| B、硫酸、纯碱、空气 |
| C、氧化铁、胆矾、熟石灰 |
| D、硝酸、烧碱、食盐水 |
在实验室用Zn与稀H2SO4反应来制取H2,常加少量CuSO4来加快反应速率.为了研究CuSO4的量对H2生成速率的影响,某同学设计了实验方案(见下表),将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间.
下列说法正确的是( )
下列说法正确的是( )
| 试剂 实验 | 甲 | 乙 | 丙 | 丁 |
| 4mol?L-1H2SO4/mL | 20 | V1 | V2 | V3 |
| 饱和CuSO4溶液/mL | 0 | 2.5 | V4 | 10 |
| H2O/mL | V5 | V6 | 8 | 10 |
| 收集气体所需时间/s | t1 | t2 | t3 | t4 |
| A、t1<t2<t3<t4 |
| B、V4=V5=10 |
| C、V6=17.5 |
| D、V1<V2<V3<20 |
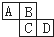 如图为周期表中的一部分.已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1.5倍.
如图为周期表中的一部分.已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1.5倍.
