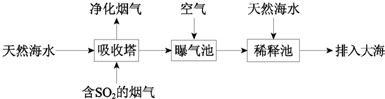
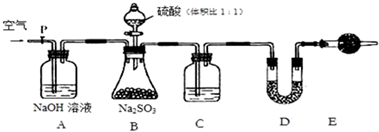
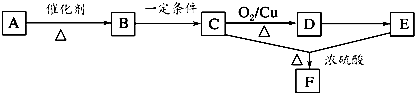
题目内容
a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;且c与f可以反应生成d与g,d分子中有两对共用电子对.试写出:
(1)a微粒的结构示意图 .
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示).
(3)g微粒的形成过程,用电子式表示为 .
(4)c微粒的电子式是 .
(5)写出与d微粒所含元素相同,且分子中原子个数比为1:1的分子的结构式 .
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 核电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)a微粒的结构示意图
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为
(3)g微粒的形成过程,用电子式表示为
(4)c微粒的电子式是
(5)写出与d微粒所含元素相同,且分子中原子个数比为1:1的分子的结构式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:a是单核且含有10电子的微粒,则a是Ne;b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d分子中有两对共用电子对,则d是H2O;e是单核带2个单位正电荷的10电子阳离子,则e是Mg 2+;f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,且c与f可以反应生成d与g,则f是NH4+、g是NH3,据此答题.
d是多核10电子分子,d分子中有两对共用电子对,则d是H2O;e是单核带2个单位正电荷的10电子阳离子,则e是Mg 2+;f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,且c与f可以反应生成d与g,则f是NH4+、g是NH3,据此答题.
解答:
解:a是单核且含有10电子的微粒,则a是Ne;b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;c是双核10电子微粒,且带一个单位负电荷,则c是OH-;d是多核10电子分子,d分子中有两对共用电子对,则d是H2O;e是单核带2个单位正电荷的10电子阳离子,则e是Mg 2+;f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,且c与f可以反应生成d与g,则f是NH4+、g是NH3,
(1)a是Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为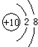 ,
,
故答案为: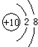 ;
;
(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(3)电子式表示NH3的形成过程为 ,
,
故答案为: ;
;
(4)OH-的电子式是 ,
,
故答案为: ;
;
(5)写出与d微粒所含元素相同,且分子中原子个数比为1:1的为双氧水,分子的结构式为H-O-O-H,
故答案为:H-O-O-H;
(1)a是Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为
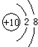 ,
,故答案为:
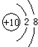 ;
;(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(3)电子式表示NH3的形成过程为
 ,
,故答案为:
 ;
;(4)OH-的电子式是
 ,
,故答案为:
 ;
; (5)写出与d微粒所含元素相同,且分子中原子个数比为1:1的为双氧水,分子的结构式为H-O-O-H,
故答案为:H-O-O-H;
点评:本题主要考查了10电子微粒,难度不大,解题的关键是正确推断10电子微粒的种类,答题时注意化学用语的正确表达.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B、氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、稀盐酸滴在石灰石上:CaCO3+2H+=Ca2++H2CO3 |
当光束通过下列分散系:①稀硫酸 ②雾 ③蒸馏水 ④墨水,能观察到丁达尔效应的有( )
| A、①③ | B、②③ | C、②④ | D、③④ |
下列关于离子反应的叙述中,错误的是( )
| A、溶液中发生的复分解反应肯定是离子反应 |
| B、离子反应并不一定要有水、有气体、有沉淀生成才能发生 |
| C、醋酸钠中滴入硫酸也能发生离子反应 |
| D、氯气和水的反应不属于离子反应 |
常温下,某0.01mol?L-1一元酸HX的电离常数K=1.0×10-6,测得其pH=4.下列有关推断不正确的是( )
A、该溶液中
| ||
| B、等物质的量浓度、等体积HX溶液和氨水混合,混合液一定呈中性 | ||
| C、等体积的pH=11的NaOH溶液和pH=3的HX的溶液混合,溶液呈酸性 | ||
| D、在HX溶液中滴加烧碱溶液,可能存在:c(Na+)>c(OH-)>c(X-)>c(H+) |