题目内容
20.N2O4是无色气体,在恒容密闭容器中充人N2O4(g),在一定条件下发生反应:N2O4(g)?2NO2(g).下列情况不能说明反应达到平衡状态的是( )| A. | 混合气体颜色不再变化 | B. | 混合气体密度不再变化 | ||
| C. | 2v正(N2O4)=v逆(NO2) | D. | 混合气体相对分子质量不变 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.混合气体颜色不再变化,说明二氧化氮的浓度不再发生变化,能说明反应达到平衡状态,故A不选;
B.该反应前后气体物质的量之和不变,所以恒温恒压条件下该容器体积不变,混合气体质量不变,所以密度始终不变,则不能根据密度判断平衡状态,故B选;
C.2v正(N2O4)=v逆(NO2),说明正逆反应速率相等,该反应达到平衡状态,故C不选;
D.反应后混合气体物质的量增大,混合气体质量始终不变,则混合气体平均相对分子质量逐渐减小,混合气体相对分子质量不变,说明各物质的物质的量保持不变,所以能据此判断平衡状态,故D不选;
故选B.
点评 本题考查化学平衡状态判断,题目难度不大,只有反应前后改变的物理量才能作为平衡状态判断依据,为易错题,侧重于考查学生对基础知识的理解和应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.短周期元素甲~戊在元素周期表中的相对位置如表所示,且它们都是金属元素.下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 甲、丙与水反应的剧烈程度:丙<甲 | |
| B. | 金属性:丙>乙 | |
| C. | 氢氧化物碱性:丙<丁<戊 | |
| D. | 丙与戊它们对应的最高价氧化物的水化物间不能发生反应 |
11.有A、B、C、D四种金属,做如下实验:①将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;②将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈;③将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | A>B>C>D | B. | C>D>A>B | C. | D>A>B>C | D. | A>B>D>C |
15.香柠檬油可用于化妆品.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )


| A. | 香柠檬醚分子式为C13H9O4 | |
| B. | 香柠檬醚最多可与7 mol H2发生加成反应 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
9.硫酸工业生产应考虑综合经济效益问题,根据下面工业生产硫酸的工艺流程图回答有关问题:
(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.

(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.
7.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 密闭容器中1mol N2与3mol H2充分反应,产物的分子数为2NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+个数为2NA | |
| C. | 在标准状况下,22.4L溴所含的原子数目为2NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
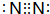 .
.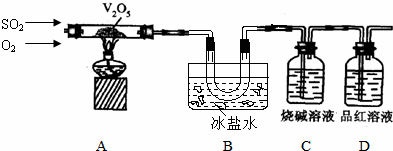
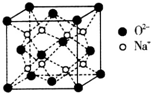 H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题: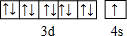 .
.