题目内容
8.由原子序数依次增大的五种短周期元素A、B、C、D、E,已知A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素最高价氧化物的水化物与其氢化物反应生成一种盐;A、B、C、E四种元素分别都能与D元素形成原子个数比不相同的多种常见化合物,回答下列问题:(1)B在周期表中的位置是第二周期IVA族,C元素的单质的电子式
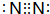 .
.(2)由A、B、C、D四种元素组成的一种离子化合物X,已知1molX能与足量NaOH浓溶液发生反应生成标准状况下4.48L气体.则X的化学式为(NH4)2CO3.
(3)E与D形成的一种化合物与BD2发生氧化还原反应,该反应的化学方程式为2Na2O2+2CO2=2Na2O3+O2.
(4)用A和D两元素组成的单质可以制成一种燃料电池,电池中装有浓KOH溶液.用多孔的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过的隔膜,在一极通入A的单质,另一极通入D的单质.则该电池正极的电极反应式为O2+2H2O+4e-=4OH-.
(5)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染.已知1mol C2A4和C2D4完全反应生成两种气体时放出热量516.8KJ,则该反应的热化学方程式为2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1033.6 kJ•mol-1.
分析 由原子序数依次增大的五种短周期元素A、B、C、D、E,B元素原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;A元素的原子半径最小,则A为H元素;A、E同主族,E的原子序数大于碳,故E为Na;C元素最高价氧化物的水化物与其氢化物反应生成一种盐,则C为N元素;A、B、C、E四种元素分别都能与D元素形成原子个数比不相同的多种常见化合物,则D为O元素.
解答 解:由原子序数依次增大的五种短周期元素A、B、C、D、E,B元素原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;A元素的原子半径最小,则A为H元素;A、E同主族,E的原子序数大于碳,故E为Na;C元素最高价氧化物的水化物与其氢化物反应生成一种盐,则C为N元素;A、B、C、E四种元素分别都能与D元素形成原子个数比不相同的多种常见化合物,则D为O元素.
(1)B为碳元素,在周期表中的位置是第二周期IVA族,C元素的单质为N2,电子式为: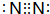 ,
,
故答案为:第二周期IVA族;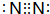 ;
;
(2)由A、B、C、D四种元素组成的一种离子化合物X,1molX能与足量NaOH浓溶液发生反应生成标准状况下4.48L气体,即生成氨气为2mol,则X为(NH4)2CO3,
故答案为:(NH4)2CO3;
(3)E与D形成的一种化合物与CO2发生氧化还原反应,该反应的化学方程式为:2Na2O2+2CO2=2Na2O3+O2,
故答案为:2Na2O2+2CO2=2Na2O3+O2;
(4)氢气、氧气可以制成一种燃料电池,电池中装有浓KOH溶液,原电池正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,则该电池正极的电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(5)N2H4和N2O4燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染,反应生成氮气与水,反应方程式为:2N2H4+N2O4═3N2+4H2O,已知1mol N2H4和N2O4完全反应生成两种气体时放出热量516.8KJ,则该反应的热化学方程式为2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1033.6 kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1033.6 kJ•mol-1.
点评 本题考查结构性质位置关系、元素化合物性质、原电池、热化学方程式书写等,是对学生综合能力的考查.

| A. | H20 | B. | MgCl2 | C. | HNO3 | D. | Na2O2 |
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | Y的最高正价为+6 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
| A. | 电解过程中阴极没有气体生成 | |
| B. | 电解过程中转移的电子的物质的量为0.4 mol | |
| C. | 原CuSO4溶液的浓度为0.1 mol•L-1 | |
| D. | 电解过程中阳极收集到的气体体积为2.24 L(标况下) |
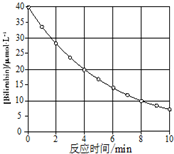 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )| A. | 2.5 μmol•L-1•min-1 和2.0 μmol•L-1•min-1 | |
| B. | 2.5 μmol•L-1•min-1 和2.5 μmol•L-1•min-1 | |
| C. | 3.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 | |
| D. | 5.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 |
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |
| A. | 混合气体颜色不再变化 | B. | 混合气体密度不再变化 | ||
| C. | 2v正(N2O4)=v逆(NO2) | D. | 混合气体相对分子质量不变 |
| A. | CH3-CH2-NO2 和 H2N-CH2-COOH | B. | H和D | ||
| C. | 甲烷和正丁烷 | D. | 红磷和白磷 |
 元素周期表的排列和分区与元素基态原子核外电子的排布息息相关,请据此回答下列问题:
元素周期表的排列和分区与元素基态原子核外电子的排布息息相关,请据此回答下列问题: