题目内容
10.短周期元素甲~戊在元素周期表中的相对位置如表所示,且它们都是金属元素.下列判断正确的是( )| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 甲、丙与水反应的剧烈程度:丙<甲 | |
| B. | 金属性:丙>乙 | |
| C. | 氢氧化物碱性:丙<丁<戊 | |
| D. | 丙与戊它们对应的最高价氧化物的水化物间不能发生反应 |
分析 由短周期金属元素甲~戊在元素周期表的相对位置,可知甲为Li、乙为Be、丙为Na、丁为Mg、戊为Al.
A.同主族自上而下金属性增强,金属性越强,单质与水反应越剧烈;
B.同周期自左而右金属性减弱,同主族自上而下金属性增强;
C.金属性越强,最高价氧化物对应水化物的碱性越强;
D.丙与戊它们对应的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水.
解答 解:由短周期金属元素甲~戊在元素周期表的相对位置,可知甲为Li、乙为Be、丙为Na、丁为Mg、戊为Al.
A.同主族自上而下金属性增强,则金属性丙>甲,金属性越强,单质与水反应越剧烈,故A错误;
B.同周期自左而右金属性减弱,同主族自上而下金属性增强,故金属性丙>乙,故B正确;
C.同周期自左而右金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,故最高价氧化物对应水化物的碱性:丙>丁>戊,故C错误;
D.丙与戊它们对应的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,故D错误.
故选:B.
点评 本题考查元素周期表与元素周期律,比较基础,注意对元素周期表的整体把握,掌握同周期、同主族元素化合物性质相似性与递变性.

练习册系列答案
相关题目
1.草酸是二元弱酸,草酸氢钾溶液呈酸性.在0.01mol/L KHC2O4溶液中,下列关系正确的是( )
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42- ) | B. | c(HC2O4-)+c(C2O42-)=0.01 mol•L-1 | ||
| C. | c(C2O42- )<c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42- ) |
18.下列既含有离子键又含有共价键的化合物是( )
| A. | H20 | B. | MgCl2 | C. | HNO3 | D. | Na2O2 |
5.下列说法正确的是( )
| A. | 可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| B. | 氯水、氨水、浓硝酸都要存放在棕色瓶里 | |
| C. | 铵态氮肥不能与草木灰混合使用,但可以暴晒在太阳底下 | |
| D. | SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
15.某同学为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能检验出一定存在的离子是( )
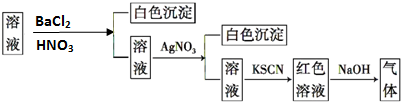

| A. | SO42-、NH4+ | B. | Cl- | C. | Fe3+ | D. | NH4+ |
2.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 蔗糖溶于水 | D. | SO2气体溶于水 |
19.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | Y的最高正价为+6 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
20.N2O4是无色气体,在恒容密闭容器中充人N2O4(g),在一定条件下发生反应:N2O4(g)?2NO2(g).下列情况不能说明反应达到平衡状态的是( )
| A. | 混合气体颜色不再变化 | B. | 混合气体密度不再变化 | ||
| C. | 2v正(N2O4)=v逆(NO2) | D. | 混合气体相对分子质量不变 |