题目内容
2.某实验小组同学采用下列装置模拟硫酸工业的接触室,制备SO3并测定实验条件下SO2的转化率.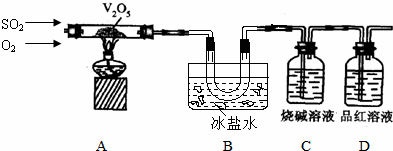
(1)实验过程中,当V2O5表面红热后,应将酒精灯移开一段时间后再继续加热,其原因是该反应放热,如果持续加热则温度过高会影响催化剂的活性,影响反应速率;温度过高会使平衡向逆反应方向移动不利于SO3的生成.
(2)结束实验时应先停止通入SO2,并继续通入一段时间O2.
(3)为了除去SO2气体中混有的少量SO3,还可以让混合气体通过饱和亚硫酸氢钠溶液(除了图示方法).为了检验SO2气体中是否混有少量SO3,可以让混合气体通过氯化钡溶液;若有白色沉淀现象出现,说明SO2气体中混有SO3.
(4)为了测定该条件下SO2的转化率,若B中U型管内收集到的物质的质量为m g,还需要测定的实验数据是C瓶溶液增重的质量C瓶溶液增重的质量.实际测得SO2的转化率比理论值小,其主要原因有A、D.
A、装置C中亚硫酸盐被氧化 B、SO2通入速度太快,未被充分吸收
C、有SO2残留在A、B装置中 D、SO3挥发,被装置C吸收.
分析 (1)二氧化硫转化为三氧化硫的反应为放热反应,结合温度对催化剂活性的影响分析;
(2)实验结束时,要把未反应的二氧化硫全部排入C中;
(3)根据SO3与亚硫酸氢钠溶液反应生成SO2来分析除杂试剂,利用SO3与氯化钡反应产生白色沉淀而SO2不与氯化钡反应来检验SO2气体中是否混有少量SO3;
(4)U型管内收集到的物质为三氧化硫,还需要知道剩余的二氧化硫的质量;SO2的转化率=$\frac{参加反应的二氧化硫质量}{参加反应的二氧化硫的质量+剩余的二氧化硫的质量}$,根据该公式中数据的变化分析.
解答 解:(1)由二氧化硫转化为三氧化硫的反应:2SO2+O?2SO3,△H<0,可知道该反应放热,如果持续加热则温度过高会影响催化剂的活性,影响反应速率;温度过高会使平衡向逆反应方向移动不利于SO3的生成,
故答案为:该反应放热,如果持续加热则温度过高会影响催化剂的活性,影响反应速率;温度过高会使平衡向逆反应方向移动不利于SO3的生成;
(2)实验结束时,要把未反应的二氧化硫全部排入C中,则应该先停止通二氧化硫,再通一段时间的氧气把二氧化硫全部排入C中,
故答案为:通入二氧化硫;通入一段时间的氧气;
(3)饱和NaHSO3溶液与SO3、水反应,除去SO3气体,同时生成SO2气体,不引入新杂质,且饱和NaHSO3溶液还可以降低SO2气体的溶解度,则除杂试剂为饱和NaHSO3溶液;SO3与氯化钡反应产生白色沉淀而SO2不与氯化钡反应,SO3+H2O+BaCl2 =BaSO4↓+2HCl,所以检验SO2气体中是否混有少量SO3,可以让混合气体通过氯化钡溶液,若有白色沉淀出现,说明SO2气体中混有SO3,
故答案为:饱和亚硫酸氢钠;氯化钡;白色沉淀;
(4)U型管内收集到的物质为三氧化硫,要计算二氧化硫的转化率,还需要知道剩余的二氧化硫的质量,即C瓶溶液增加的质量;
SO2的转化率=$\frac{参加反应的二氧化硫质量}{参加反应的二氧化硫的质量+剩余的二氧化硫的质量}$,根据该公式中数据的变化分析:
A、装置C中亚硫酸盐被氧化,则C瓶溶液增加的质量偏大,即剩余的二氧化硫的质量偏大,所以SO2的转化率偏小,故A选;
B、SO2通入速度太快,未被充分吸收,则C瓶溶液增加的质量偏小,即剩余的二氧化硫的质量偏小,所以SO2的转化率偏大,故B不选;
C、有SO2残留在A、B装置中,则C瓶溶液增加的质量偏小,即剩余的二氧化硫的质量偏小,所以SO2的转化率偏大,故C不选;
D、SO3挥发,被装置C吸收,则C瓶溶液增加的质量偏大,即剩余的二氧化硫的质量偏大,所以SO2的转化率偏小,故D选;
故答案为:C瓶溶液增加的质量;AD.
点评 本题考查了二氧化硫转化为三氧化硫的实验方案设计,侧重于实验装置综合性考查,注意把握误差分析的方法,题目难度中等.

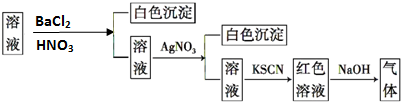
| A. | SO42-、NH4+ | B. | Cl- | C. | Fe3+ | D. | NH4+ |
| A. | 电解过程中阴极没有气体生成 | |
| B. | 电解过程中转移的电子的物质的量为0.4 mol | |
| C. | 原CuSO4溶液的浓度为0.1 mol•L-1 | |
| D. | 电解过程中阳极收集到的气体体积为2.24 L(标况下) |
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |
| A. | 混合气体颜色不再变化 | B. | 混合气体密度不再变化 | ||
| C. | 2v正(N2O4)=v逆(NO2) | D. | 混合气体相对分子质量不变 |
| A. | 纤维素水解的产物可以制乙醇 | |
| B. | 乙烯、聚乙烯、聚氯乙烯都属于烃,都可以使溴水褪色 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | NH4NO3、KNO3、KClO3与Na2S、C2H5OH混合搭存放在同一仓库 |
| X | Y | |
| Z | R | |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律,可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | ZY2晶体熔化、液态RY3气化均需克服分子间作用力 |
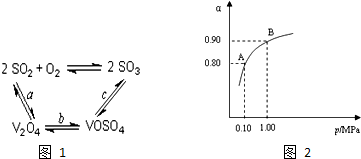 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题: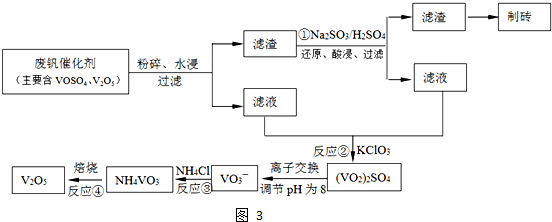
 元素周期表的排列和分区与元素基态原子核外电子的排布息息相关,请据此回答下列问题:
元素周期表的排列和分区与元素基态原子核外电子的排布息息相关,请据此回答下列问题: