题目内容
13.下列叙述正确的是( )| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | HClO见光会分解,故氯水保存在棕色试剂瓶中 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
分析 A.SO2具有漂白性,故可作漂白剂,不是还原性;
B.Na与水反应生成NaOH和氢气,后与氯化镁反应生成氢氧化镁和氯化钠;
C.见光分解的物质应保存在棕色试剂瓶中;
D.Fe与S反应生成FeS.
解答 解:A.二氧化硫的漂白性,是和有色物质结合为无色不稳定的物质,不是还原性,故A错误;
B.Na与水反应生成NaOH和氢气,后NaOH与氯化镁反应生成氢氧化镁和氯化钠,因Na化学性质活泼,不会置换出Mg,故B错误;
C.见光分解的物质应保存在棕色试剂瓶中,则HClO见光会分解,故氯水保存在棕色试剂瓶中,故C正确;
D.Fe与S反应生成FeS,与氧气反应生成四氧化三铁、与氯气反应生成FeCl3,反应产物取决于非金属的氧化性,故D错误;
故选C.
点评 本题考查物质的性质,综合考查元素化合物性质,为高频考点,把握二氧化硫、钠、浓硫酸、氯气等物质的性质为解答的关键,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
5.某烃的分子式为C4H8,已知它能使酸性KMnO4溶液褪色,完全燃烧时生成等物质的量的CO2与H2O,则它与HBr加成反应时,最多可得到几种不同(不考虑立体异构)的产物( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
4.关于0.2mol/L的NaOH溶液,下列说法错误的是( )
| A. | 100mL该溶液中含0.8g NaOH | |
| B. | 200mL该溶液与100mL 0.2 mol/L的硫酸溶液反应形成中性溶液 | |
| C. | 100mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+ | |
| D. | 取NaOH 8g溶于1L水中即得到1L该溶液 |
1.在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 混合气体的相对分子质量 | D. | C气体的总物质的量浓度 |
5.C、N、S是重要的非金属元素,下列说法正确的是( )
| A. | 三种元素均可以和氧元素形成2种或2种以上氧化物 | |
| B. | 实验室用铜和浓硝酸反应制取NO | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 稀硫酸、稀硝酸与铁的反应均属于置换反应 |
2.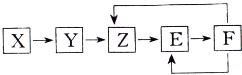 下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )
下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )
 下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )
下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )| A. | X一定含有氮元素,可能是单质也可能是化合物 | |
| B. | X→Y一定是氧化还原反应 | |
| C. | 常温下F与碳单质反应可能生成Z | |
| D. | 若X为单质,Y→Z可能属于化合反应 |
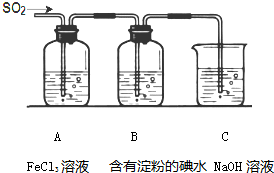 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: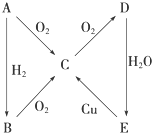 根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关反应的化学方程式:
根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关反应的化学方程式: 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.