题目内容
4.关于0.2mol/L的NaOH溶液,下列说法错误的是( )| A. | 100mL该溶液中含0.8g NaOH | |
| B. | 200mL该溶液与100mL 0.2 mol/L的硫酸溶液反应形成中性溶液 | |
| C. | 100mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+ | |
| D. | 取NaOH 8g溶于1L水中即得到1L该溶液 |
分析 A.根据n=cV计算NaOH物质的量,再根据m=nM计算其质量;
B.根据n=cV计算NaOH、硫酸的物质的量,结合方程式2NaOH+H2SO4=Na2SO4+2H2O判断;
C.根据n=cV计算Na+物质的量,再根据N=nNA计算;
D.NaOH为8g,计算物质的量n=$\frac{m}{M}$,溶液体积为1L,不是溶剂水的体积.
解答 解:A.NaOH物质的量=0.1L×0.2mol/L=0.02mol,其质量=0.02mol×40g/mol=0.8g,故A正确;
B.NaOH物质的量=0.2L×0.2mol/L=0.04mol,硫酸的物质的量=0.1L×0.2mol/L=0.02mol,由方程式2NaOH+H2SO4=Na2SO4+2H2O,可知二者恰好反应,所得溶液为硫酸钠溶液,溶液呈中性,故B正确;
C.Na+物质的量=0.1L×0.2mol/L=0.02mol,约含0.02mol×6.02×1023mol-1个Na+,故C正确;
D.NaOH为8g,计算物质的量n=$\frac{m}{M}$=$\frac{8g}{40g/mol}$=0.2mol,溶于1L水中,溶液体积大于1L,浓度小于0.2mol/L,故D错误,
故选D.
点评 本题考查物质的量浓度,比较基础,注意对概念的理解与公式的灵活应用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.在酸性溶液中,下列离子不能大量存在的是( )
| A. | Mg2+ | B. | OHˉ | C. | SO42- | D. | Fe3+ |
17.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、NH4+ | B. | Ag+、NO3-、Cl-、OH- | ||
| C. | K+、Ba2+、OH-、H+ | D. | NH4+、Br-、OH-、Mg2+ |
12.NaHCO3、Na2CO3、NaOH的混合物与200mL物质的量浓度为1mol/L的盐酸恰好完全反应,蒸干溶液,最终得到的固体质量为( )
| A. | 8g | B. | 15.5g | C. | 11.7g | D. | 无法计算 |
19.下列有关物理量相应的单位表达错误的是( )
| A. | 摩尔质量g/mol | B. | 气体摩尔体积mol/L | ||
| C. | 阿伏伽德罗常数/mol | D. | 密度g/cm3 |
13.下列叙述正确的是( )
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | HClO见光会分解,故氯水保存在棕色试剂瓶中 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
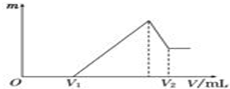 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: