题目内容
8.已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ.由此可以推知下列关系正确的是( )| A. | Q1>Q3 | B. | Q2>Q3 | C. | 2Q1+Q2<2Q3 | D. | 2Q1+Q2<4Q3 | ||||
| E. | Q1+Q2>Q3 | F. | Q1+Q2<Q3 |
分析 根据旧键断裂吸收的能量减去新键生成释放的能量值即为反应热解答,燃烧反应为放热反应,由此分析解答.
解答 解:1molH2O中含2molH-O键,断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ,则成1molO-H键放出Q3kJ热量,对于反应H2(g)+$\frac{1}{2}$O2(g)=H2O(g),断开1 mol O=O键和1 molH-O键所吸收的能量Q1+$\frac{1}{2}$Q2,生成新键释放的能量2Q3,该反应放热,2Q3-(Q1+$\frac{1}{2}$Q2)>0,即2Q1+Q2<2Q3,
故选C.
点评 本题考查了化学反应与能量变化,注意掌握反应热的概念,1molH2O中含2molH-O键为解答易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.巴豆酸的结构简式为CH3-CH═CH-COOH.现有①氯化氢、②溴水、③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③④ | D. | 全部 |
8.在常温常压下,把1molO2和4molN2混合后占有的体积是( )
| A. | 22.4L | B. | 89.6L | C. | 112L | D. | 大于112L |
13.下列说法正确的是( )
| A. | 卤素元素都有正化合价 | B. | 卤素元素的单质都只具有氧化性 | ||
| C. | 卤素元素的最低化合价都是-1价 | D. | 卤素元素氢化物都是强酸 |


 ;
;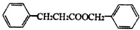 .
.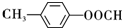 .
.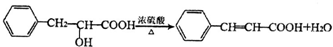 ;F→G
;F→G .
.

 .
. .
.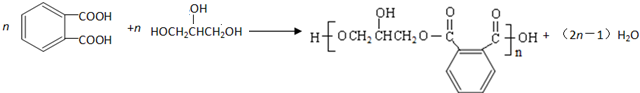 .
. 互为同分异构体的结构简式
互为同分异构体的结构简式 .
.
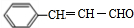
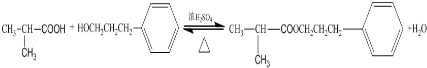
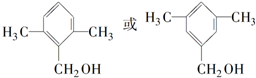 .
.