题目内容
3.氯化铝水溶液呈酸性,原因是(用离子方程式表示):Al3++3H2O?Al(OH)3+3H+.分析 氯化铝是强酸弱碱盐,溶液中氯离子水解结合水电离出氢氧根离子,促进水电离平衡正向进行溶液显酸性.
解答 解:氯化铝是强酸弱碱盐,溶液中氯离子水解结合水电离出氢氧根离子,促进水电离平衡正向进行溶液显酸性,反应的离子方程式为Al3++3H2O?Al(OH)3+3H+,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+.
点评 本题考查了盐类水解原理的分析判断,掌握实质是解题关键,题目难度不大.

练习册系列答案
相关题目
5.石油减压分馏的目的是( )
| A. | 使高沸点的重油进一步分离 | B. | 分离得到汽油、煤油等轻质油 | ||
| C. | 得到高质量的汽油 | D. | 得到更多的优质重油 |
6.下列有关电解质溶液中微粒的物质的量浓度关系错误的是( )
| A. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 常温下,CH3COONa和CH3COOH混合溶液(已知:pH=7,c(Na+)=0.1 mol•L-1):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 在0.1 mol•L-1Na2S溶液中:c(OH-)-c(H+)=c(HS-)+2c(H2S) |
3.下列实验操作、现象、结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将溴乙烷与NaOH溶液共热后,滴加AgNO3溶液检测溴乙烷含Br原子 | 产生浅黄色沉淀 | 溴乙烷水解产生Br-离子与AgNO3溶液产生AgBr沉淀 |
| B | 向鸡蛋清水溶液中加CuSO4溶液 | 产生白色浑浊 | 蛋白质加盐,发生了盐析 |
| C |  | 产生的气体会使KMnO4溶液褪色 | 石蜡油在碎瓷片作催化剂下裂解产生了不饱和烃 |
| D |  | 气体黄绿色变浅,量筒壁有油状液滴,液面上升 | 甲烷和氯气发生了氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
10.下列操作达不到预期目的是( )
①石油分馏时把温度计插入受热的液体中
②用饱和碳酸钠溶液除去乙酸乙酯中混有的乙醇、乙酸.
③用酸性高锰酸钾溶液除去乙炔中的乙烯
④将苯和溴水混合后加入铁粉制取溴苯.
①石油分馏时把温度计插入受热的液体中
②用饱和碳酸钠溶液除去乙酸乙酯中混有的乙醇、乙酸.
③用酸性高锰酸钾溶液除去乙炔中的乙烯
④将苯和溴水混合后加入铁粉制取溴苯.
| A. | 只有① | B. | 只有①③④ | C. | 只有①②③ | D. | ①②③④ |
8.已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ.由此可以推知下列关系正确的是( )
| A. | Q1>Q3 | B. | Q2>Q3 | C. | 2Q1+Q2<2Q3 | D. | 2Q1+Q2<4Q3 | ||||
| E. | Q1+Q2>Q3 | F. | Q1+Q2<Q3 |
15.下列解释物质用途的反应方程式不正确的是( )
| A. | 用Fe2(SO4)3净水 Fe3++3H2O?Fe(OH)3+3H+ | |
| B. | 用Na2S处理含Hg2+废水 Hg2++S2-═HgS↓ | |
| C. | 用Na2CO3溶液处理水垢中的CaSO4 Ca2++CO32-═CaCO3↓ | |
| D. | 燃煤时加入石灰石,减少SO2排放 2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 |

 ;⑤nCH2=CH2$\stackrel{催化剂}{→}$
;⑤nCH2=CH2$\stackrel{催化剂}{→}$ .
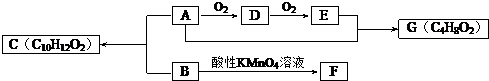
.
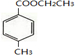 .
.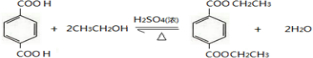 .
.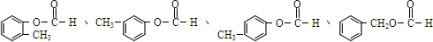 .
.