题目内容
13.下列说法正确的是( )| A. | 卤素元素都有正化合价 | B. | 卤素元素的单质都只具有氧化性 | ||
| C. | 卤素元素的最低化合价都是-1价 | D. | 卤素元素氢化物都是强酸 |
分析 A、氟是最活泼的非金属,没有正价;
B、卤素在反应中可以失去电子,具有还原性;
C、卤素元素的最外层电子数都是7个;
D、氢氟酸是弱电解质.
解答 解:A、氟是最活泼的非金属,没有正价,所以卤素元素并不是都有正化合价,故A错误;
B、卤素在反应中可以失去电子,具有还原性,如氯气与水反应生成盐酸和次氯酸既表现氧化性,也表现还原性,故B错误;
C、卤素元素的最外层电子数都是7个,所以易得1个电子达8电子的稳定结构,即卤素元素的最低化合价都是-1价,故C正确;
D、氢氟酸是弱电解质,水溶液显弱酸性,故D错误;
故选C.
点评 本题考查同一主族元素性质递变规律,侧重考查元素周期律的应用,以卤族元素为例熟练掌握同一周期、同一主族性质递变规律,注意规律中的异常现象,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
16.1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广泛、高效、无刺激、无腐蚀等特点,对防治禽流感、口蹄疫、猪瘟等有良好效果.根据上述信息,判断下列说法中正确的是( )
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛不能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 |
8.已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ.由此可以推知下列关系正确的是( )
| A. | Q1>Q3 | B. | Q2>Q3 | C. | 2Q1+Q2<2Q3 | D. | 2Q1+Q2<4Q3 | ||||
| E. | Q1+Q2>Q3 | F. | Q1+Q2<Q3 |
5.汽车尾气在光照下,发生光化学烟雾的循环,它的形成过程可用下面的化学方程式表示:NO2$\frac{\underline{\;光\;}}{\;}$NO+O,2NO+O2═2NO2,O+O2═O3.下列叙述中不正确的是( )
| A. | 在此过程中,NO2是氧化剂 | |
| B. | 在此过程中,NO是反应的中间产物 | |
| C. | 该过程总反应的化学方程式为2O3═3O2 | |
| D. | 光化学烟雾能引起人严重的呼吸功能障碍 |
2.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A. | 第14列元素的最高价氧化物的化学式为RO2 | |
| B. | 第2列元素中一定没有非金属元素 | |
| C. | 在18列元素中,第3列元素种类最多 | |
| D. | 第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
3.物质的量相同的下列有机物,充分燃烧耗氧量最大的是( )
| A. | C2H2 | B. | C2H6 | C. | C4H6 | D. | C4H8 |
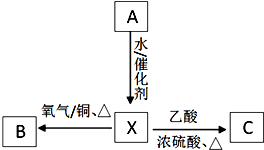 A为最简单的植物激素.有关物质的转化关系如图:
A为最简单的植物激素.有关物质的转化关系如图: [加成反应]
[加成反应]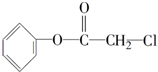 与NaOH溶液共热:
与NaOH溶液共热: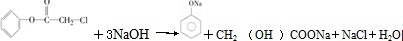 [取代反应].
[取代反应].