题目内容
8.在常温常压下,把1molO2和4molN2混合后占有的体积是( )| A. | 22.4L | B. | 89.6L | C. | 112L | D. | 大于112L |
分析 把1molO2和4molN2混合物的总的物质的量为:5mol,标准状况下体积为:5mol×22.4L/mol=112L,而在常温常压下,温度高于标准况下,所以此时气体摩尔体积大于22.4L/mol,由此分析解答.
解答 解:把1molO2和4molN2混合物的总的物质的量为:5mol,标准状况下体积为:5mol×22.4L/mol=112L,而在常温常压下,温度高于标准况下,所以此时气体摩尔体积大于22.4L/mol,所以在常温常压下,把1molO2和4molN2混合后占有的体积是大于112L,故选D.
点评 本题考查了气体摩尔体积的应用,题目难度不大,注意把握气体摩尔体积的单位、及适用条件.

练习册系列答案
 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
18.下列递变规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | B. | I2、Br2、Cl2氧化性依次减弱 | ||
| C. | C、N、O原子半径依次减小 | D. | P、S、F最高正价依次降低 |
16.1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广泛、高效、无刺激、无腐蚀等特点,对防治禽流感、口蹄疫、猪瘟等有良好效果.根据上述信息,判断下列说法中正确的是( )
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛不能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 |
3.下列实验操作、现象、结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将溴乙烷与NaOH溶液共热后,滴加AgNO3溶液检测溴乙烷含Br原子 | 产生浅黄色沉淀 | 溴乙烷水解产生Br-离子与AgNO3溶液产生AgBr沉淀 |
| B | 向鸡蛋清水溶液中加CuSO4溶液 | 产生白色浑浊 | 蛋白质加盐,发生了盐析 |
| C |  | 产生的气体会使KMnO4溶液褪色 | 石蜡油在碎瓷片作催化剂下裂解产生了不饱和烃 |
| D |  | 气体黄绿色变浅,量筒壁有油状液滴,液面上升 | 甲烷和氯气发生了氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
8.已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ.由此可以推知下列关系正确的是( )
| A. | Q1>Q3 | B. | Q2>Q3 | C. | 2Q1+Q2<2Q3 | D. | 2Q1+Q2<4Q3 | ||||
| E. | Q1+Q2>Q3 | F. | Q1+Q2<Q3 |
5.汽车尾气在光照下,发生光化学烟雾的循环,它的形成过程可用下面的化学方程式表示:NO2$\frac{\underline{\;光\;}}{\;}$NO+O,2NO+O2═2NO2,O+O2═O3.下列叙述中不正确的是( )
| A. | 在此过程中,NO2是氧化剂 | |
| B. | 在此过程中,NO是反应的中间产物 | |
| C. | 该过程总反应的化学方程式为2O3═3O2 | |
| D. | 光化学烟雾能引起人严重的呼吸功能障碍 |
6.相同温度下,将等体、积等pH的醋酸和盐酸溶液,分别加入V1 mL、V2mL的水稀释后,测得溶液的pH仍然相同,则下列关系正确的是( )
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | 无法判断 |
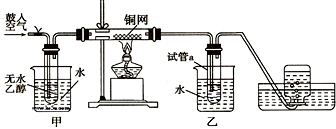
 [加成反应]
[加成反应]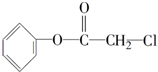 与NaOH溶液共热:
与NaOH溶液共热: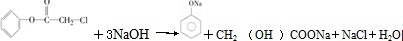 [取代反应].
[取代反应].