题目内容
5.蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下: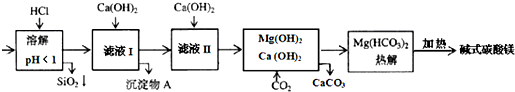
室温下,相关金属氢氧化物沉淀的KSP见下表
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| (溶度积)KSP | 4.0×10-38 | 1.25×10-33 | 1.8×10-11 |
下列说法正确的是( )
| A. | 在滤液I中,加过量的Ca(OH)2使Fe3+和Al3+沉淀完全 | |
| B. | 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全 | |
| C. | 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全 | |
| D. | 若碱式碳酸镁【aMgCO3•b Mg(OH)2】高温加热分解得到6.6g CO2和8.0g MgO,由此可知其化学式为MgCO3•3Mg(OH)2 |
分析 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,用盐酸溶解过滤得到滤液中为Mg2+、Fe3+、Al3+,加入适量的氢氧化钙沉淀得到氢氧化铝、氢氧化铁沉淀A,滤液中再加入氢氧化钙后通入二氧化碳生成碳酸氢镁和碳酸钙沉淀,过滤除去碳酸钙,得到碳酸氢镁溶液,热解得到碱式碳酸镁,
A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀;
C、根据氢氧化铝的Ksp可以求出Al3+刚好沉淀完全时的PH;
D、利用碱式碳酸镁分解:aMgCO3?bMg(OH)2$\frac{\underline{\;高温\;}}{\;}$ (a+b)MgO+aCO2↑+bH2O,根据氧化镁和二氧化碳的物质的量之比确定化学式.
解答 解:A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀,所以不能加过量的Ca(OH)2;故A错误;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀,已知Fe(OH)3的Ksp小,所以Fe(OH)3先形成沉淀,故B错误;
C、Al3+刚好沉淀完全时c(Al3+)=1.0×10-5 mol•L-1,则c(OH-)=$\root{3}{\frac{Ksp}{c(Al{\;}^{3+})}}$=$\root{3}{\frac{1.25×10{\;}^{-33}}{1.0×10{\;}^{-5}}}$=5×10-10mol•L-1,所以c(H+)=2×10-5mol•L-1,所以PH=4.7,即pH调节到4.7时,Al3+刚好沉淀完全,故C正确;
D、碱式碳酸镁分解:aMgCO3?bMg(OH)2$\frac{\underline{\;高温\;}}{\;}$ (a+b)MgO+aCO2↑+bH2O,根据题意,m(CO2)=6.6g,m(MgO)=8.0g,所以n(MgO)═0.2mol,n(CO2)═0.15mol,得:(a+b):a=0.2:0.15=4:3,所以a=3、b=1,化学式为3MgCO3•Mg(OH)2,故D错误;
故选C.
点评 本题主要考查了沉淀溶解平衡原理,Ksp的有关计算,元素化合物中金属铝、铁的性质,解题时需熟知物质间的反应原理.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | ${\;}_{6}^{13}$C原子内的中子数为6 | B. | ${\;}_{6}^{13}$C核外电子数为6 | ||
| C. | ${\;}_{6}^{13}$C质量数为13 | D. | ${\;}_{6}^{13}$C与$\frac{12}{6}$C互为同位素 |
| A. | 乙醇在一定条件下转化为乙醛,交警用K2Cr2O7检查司机是否酒驾 | |
| B. | 由甲苯硝化制对硝基甲苯,由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| C. | 乙醇分子间脱水成乙醚,溴乙烷在一定条件下脱去HCl成乙烯 | |
| D. | 油酸甘油酯通过氢化反应转变为硬脂酸甘油酯,由丙烯与水反应制丙醇 |
| A. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| D. | A1型、A3型结构为最密堆积;则A2型结构也为最密堆积 |
| A. | 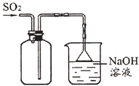 收集SO2 收集SO2 | |
| B. | 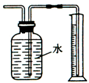 测量Cu与浓硝酸反应产生气体的体积反应 测量Cu与浓硝酸反应产生气体的体积反应 | |
| C. | 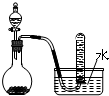 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. |  吸收HCl 吸收HCl |
| A. | 苯、己烷、四氯化碳 | B. | 苯、酒精、四氯化碳 | ||
| C. | 溴苯、酒精、四氯化碳 | D. | 硝基苯、酒精、醋酸 |
| A. | 增大反应物浓度 | B. | 加压 | C. | 升温 | D. | 加催化剂 |

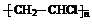 ,GHOOC(CH2)4COOH.
,GHOOC(CH2)4COOH.