题目内容
14.对于某一化学反应,下列各项反应条件改变,能增大单位体积内活化分子百分数,降低化学反应的活化能,从而提高反应速率的是( )| A. | 增大反应物浓度 | B. | 加压 | C. | 升温 | D. | 加催化剂 |
分析 增大浓度、压强,活化分子的浓度增大,但百分数不变,升高温度、加入催化剂,可增大活化分子的百分数,以此解答该题.
解答 解:温度、催化剂能增大单位体积内活化分子百分数,只有催化剂可降低化学反应的活化能,
故选D.
点评 本题考查影响反应速率的因素,为高频考点,把握浓度、温度、压强、催化剂对反应速率的影响即可解答,侧重活化理论的理解及分析的考查,题目难度不大.

练习册系列答案
相关题目
4.以下是对某水溶液进行离子检验的方法和结论,其中正确的( )
| A. | 先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀.溶液中一定含有SO42- | |
| B. | 加入足量的HCl溶液,有气体产生,将气体通入澄清石灰水有白色沉淀.溶液中一定含有CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体且该气体可以使湿润的红色石蕊试纸变蓝.溶液中一定含有NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀.溶液中一定含有Cl- |
5.蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下: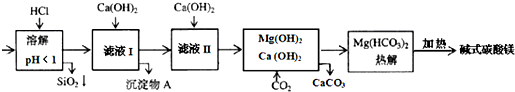
室温下,相关金属氢氧化物沉淀的KSP见下表
注:①lg2=0.3,②溶液中某离子的浓度小于1.0×10-5 mol•L-1,可认为该离子沉淀完全.
下列说法正确的是( )

室温下,相关金属氢氧化物沉淀的KSP见下表
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| (溶度积)KSP | 4.0×10-38 | 1.25×10-33 | 1.8×10-11 |
下列说法正确的是( )
| A. | 在滤液I中,加过量的Ca(OH)2使Fe3+和Al3+沉淀完全 | |
| B. | 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全 | |
| C. | 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全 | |
| D. | 若碱式碳酸镁【aMgCO3•b Mg(OH)2】高温加热分解得到6.6g CO2和8.0g MgO,由此可知其化学式为MgCO3•3Mg(OH)2 |
2.下列叙述中正确的是( )
| A. | 可用丁达尔效应区别溶液和胶体 | B. | 稀硫酸不具有氧化性 | ||
| C. | 光导纤维的主要成分是硅 | D. | 石油的分馏属于化学变化 |
9.下列离子方程式中,正确的是( )
| A. | Al与NaOH溶液的反应:Al3++3OH-=Al (OH) 3↓ | |
| B. | CaCl2溶液与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | CaCO3与稀盐酸反应:CO32-+2 H+=H2CO3 |
19.下列关于原电池的叙述正确的是( )
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 原电池工作时,外电路中电流的流向从原电池负极到原电池正极 | |
| C. | 原电池工作时,电解质溶液中的阴离子向负极移动 | |
| D. | 只要是放热反应就可以将其设计成原电池 |
4.下列各组溶液,不需要加入其他试剂就能鉴别的是( )
| A. | NaOH NaCl KNO3 MgCl2 | B. | NaOH NaCl HCl FeCl3 | ||
| C. | Na2SO4 BaCl2 HCl K2CO3 | D. | Na2CO3 HNO3 HCl Ba(NO3)2 |