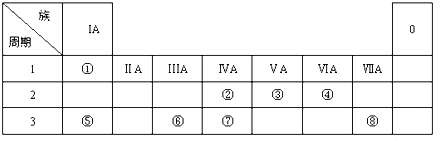
题目内容
15.${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C表示的含义错误的是( )| A. | ${\;}_{6}^{13}$C原子内的中子数为6 | B. | ${\;}_{6}^{13}$C核外电子数为6 | ||
| C. | ${\;}_{6}^{13}$C质量数为13 | D. | ${\;}_{6}^{13}$C与$\frac{12}{6}$C互为同位素 |
分析 A.中子数=质量数-质子数;
B.元素符号的左下角为质子数,原子中,质子数=核外电子数;
C.原子符号左上角数字为该原子的质量数;
D.质子数相同,而中子数不同的原子互为同位素.
解答 解:A.613C的质子数为6,质量数为13,所以原子序数为6,中子数为13-6=7,故A错误;
B.613C的质子数为6,原子中,质子数=核外电子数=6,故B正确;
C.613C的质子数为6,原子符号左上角数字为13,为该原子的质量数,故C正确;
D.126C与136C质子数均为6,中子数分别为6、7,均属碳元素的不同核素,互为同位素,故D正确;
故选A.
点评 本题考查核素的表示方法和质量数与质子数、中子数之间的关系,涉及质量数A=质子数Z+中子数N、核外电子数=质子数=核电荷数=原子序数的应用,题目难度不大.

练习册系列答案
相关题目
3.将一定量的SO2和O2放入一定体积的密闭容器中,500℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)?2SO3(g),不能作为判断该反应达到平衡状态的标志是( )
| A. | 容器中气体密度保持不变 | |
| B. | 容器中混合气体的平均相对分子质量保持不变 | |
| C. | 容器中气体的压强保持不变 | |
| D. | 单位时间内,消耗amol O2的同时生成2amol SO2 |
10.下列物质反应可制得纯净氯乙烷的是( )
| A. | 乙烯通入盐酸 | B. | 乙烯与氯化氢加成 | ||
| C. | 乙烷与氯气在光照条件下反应 | D. | 乙烷通入氯水 |
20.下列有关化学用语使用正确的是( )
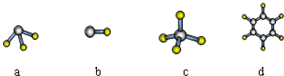
| A. | CH4 分子的比例模型: | B. | NH4Cl的电子式: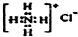 | ||
| C. | 硫离子的离子结构示意图: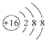 | D. | 乙烯的结构简式CH2 CH2 |
4.以下是对某水溶液进行离子检验的方法和结论,其中正确的( )
| A. | 先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀.溶液中一定含有SO42- | |
| B. | 加入足量的HCl溶液,有气体产生,将气体通入澄清石灰水有白色沉淀.溶液中一定含有CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体且该气体可以使湿润的红色石蕊试纸变蓝.溶液中一定含有NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀.溶液中一定含有Cl- |
5.蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下: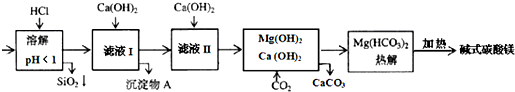
室温下,相关金属氢氧化物沉淀的KSP见下表
注:①lg2=0.3,②溶液中某离子的浓度小于1.0×10-5 mol•L-1,可认为该离子沉淀完全.
下列说法正确的是( )

室温下,相关金属氢氧化物沉淀的KSP见下表
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| (溶度积)KSP | 4.0×10-38 | 1.25×10-33 | 1.8×10-11 |
下列说法正确的是( )
| A. | 在滤液I中,加过量的Ca(OH)2使Fe3+和Al3+沉淀完全 | |
| B. | 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全 | |
| C. | 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全 | |
| D. | 若碱式碳酸镁【aMgCO3•b Mg(OH)2】高温加热分解得到6.6g CO2和8.0g MgO,由此可知其化学式为MgCO3•3Mg(OH)2 |