题目内容
10.下列实验方法或操作能达到实验目的是( )| A. | 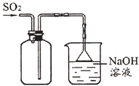 收集SO2 收集SO2 | |
| B. | 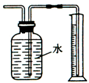 测量Cu与浓硝酸反应产生气体的体积反应 测量Cu与浓硝酸反应产生气体的体积反应 | |
| C. | 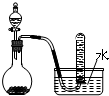 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. |  吸收HCl 吸收HCl |
分析 A.二氧化硫密度大于空气,应该用向上排空气法收集;
B.Cu和浓硝酸反应生成的二氧化氮能和水反应生成NO;
C.双氧水在二氧化锰作催化剂条件下发生分解反应生成氧气,氧气不易溶于水,可以采用排水法收集;
D.含有缓冲装置的能防止倒吸.
解答 解:A.二氧化硫密度大于空气,应该用向上排空气法收集,则导气管应该采用“长进短出”原则,故A错误;
B.Cu和浓硝酸反应生成的二氧化氮能和水反应生成NO,所以收不到二氧化氮,故B错误;
C.双氧水在二氧化锰作催化剂条件下发生分解反应生成氧气,氧气不易溶于水,可以采用排水法收集,所以该反应可以制取、收集氧气,故C正确;
D.含有缓冲装置的能防止倒吸,HCl极易溶于水而不易溶于苯,没有缓冲作用,不能防止倒吸,应该用四氯化碳,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生实验操作、实验评价能力,明确实验原理、物质性质、实验操作规范性是解本题关键,涉及气体的收集、尾气处理等,题目难度不大.

练习册系列答案
相关题目
20.下列有关化学用语使用正确的是( )
| A. | CH4 分子的比例模型: | B. | NH4Cl的电子式: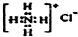 | ||
| C. | 硫离子的离子结构示意图: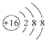 | D. | 乙烯的结构简式CH2 CH2 |
1.下列原子或离子原子核外电子排布不属于基态排布的是( )
| A. | Na 1s22s22p53s2 | B. | S2- 1s22s22p63s23p6 | ||
| C. | N 1s22s22p3 | D. | Si 1s22s22p63s23p2 |
18.等质量的下列各烃,完全燃烧后消耗氧气最多的是( )
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | CH4 |
5.蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下: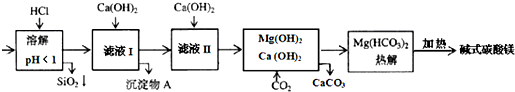
室温下,相关金属氢氧化物沉淀的KSP见下表
注:①lg2=0.3,②溶液中某离子的浓度小于1.0×10-5 mol•L-1,可认为该离子沉淀完全.
下列说法正确的是( )

室温下,相关金属氢氧化物沉淀的KSP见下表
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| (溶度积)KSP | 4.0×10-38 | 1.25×10-33 | 1.8×10-11 |
下列说法正确的是( )
| A. | 在滤液I中,加过量的Ca(OH)2使Fe3+和Al3+沉淀完全 | |
| B. | 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全 | |
| C. | 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全 | |
| D. | 若碱式碳酸镁【aMgCO3•b Mg(OH)2】高温加热分解得到6.6g CO2和8.0g MgO,由此可知其化学式为MgCO3•3Mg(OH)2 |
15.下列关于有机物的名称及表示方法均正确的是( )
| A. | 甲酸甲酯的结构简式:C2H4O2 | B. | 乙醛分子的比例模型: | ||
| C. | 聚对羟基苯甲酸酯的结构简式: | D. | 丙烷分子的球棍模型: |
2.下列叙述中正确的是( )
| A. | 可用丁达尔效应区别溶液和胶体 | B. | 稀硫酸不具有氧化性 | ||
| C. | 光导纤维的主要成分是硅 | D. | 石油的分馏属于化学变化 |
19.下列关于原电池的叙述正确的是( )
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 原电池工作时,外电路中电流的流向从原电池负极到原电池正极 | |
| C. | 原电池工作时,电解质溶液中的阴离子向负极移动 | |
| D. | 只要是放热反应就可以将其设计成原电池 |