题目内容
18.合金在生活中有广泛应用.下列物质不属于合金的是( )| A. | 硬铝 | B. | 青铜 | C. | 不锈钢 | D. | 水银 |
分析 根据合金的定义与特点进行解答.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质.合金概念有三个特点:①一定是混合物;②合金中各成分都是以单质形式存在;③合金中至少有一种金属.
解答 解:A.是指铝合金中以Cu为主要合金元素的(含2.2-4.9%Cu、0.2-1.8%Mg、0.3-0.9%Mn、少量的硅,其余部分是铝)一类 铝合金,故A不符合;
B.青铜是铜锡合金,故B不符合;
C.不锈钢是铁、镍、铬等金属形成的合金,故C不符合;
D,水银为金属汞,是金属单质不是合金,故D符合;
故选D.
点评 本题主要考查合金与合金的性质,合金概念的三个特点要记牢;本考点基础性强,比较好把握,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
9. 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
(1)取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.则稀释过程中溶液的pH由大到小的顺序a>c>b(填字母).
②配制250mL 0.4mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
③为标定该醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
该醋酸溶液的准确浓度为0.2000 mol/L(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是ad(多选、错选不得分).
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.0100 mol/L 醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于l.
②简述用pH试纸测 0.1mol/L 醋酸溶液pH的方法:用镊子取一小片pH试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照.
(3)常温下,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-)(选填“>”或“<”或“=”).
(4)若25℃时CH3COOH的电离平衡常数Ka=1.8×10-5 mol•L-1,向a L CH3COOH溶液中加入bmolCH3COONa,混合液恢复至25℃时呈中性,则原CH3COOH溶液的浓度为$\frac{b}{180a}$mol•L-1.
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.(1)取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.则稀释过程中溶液的pH由大到小的顺序a>c>b(填字母).
②配制250mL 0.4mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
③为标定该醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
②简述用pH试纸测 0.1mol/L 醋酸溶液pH的方法:用镊子取一小片pH试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照.
(3)常温下,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-)(选填“>”或“<”或“=”).
(4)若25℃时CH3COOH的电离平衡常数Ka=1.8×10-5 mol•L-1,向a L CH3COOH溶液中加入bmolCH3COONa,混合液恢复至25℃时呈中性,则原CH3COOH溶液的浓度为$\frac{b}{180a}$mol•L-1.
13.在一定温度下,反应 H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | 单位时间内生成1 mol的H2,同时生成2 mol 的HI | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 1mol I-I 键断裂的同时有2mol HI键形成 | |
| D. | 容器内气体颜色不再变化 |
3.根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是( )
| A. | PCl3 | B. | H3O+ | C. | NO3- | D. | PH3 |
10.下列反应能用离子方程式OH-+HCO3-→CO32-+H2O表示的是( )
| A. | NaOH+NaHCO3→Na2CO3+H2O | |
| B. | Ca(OH)2+Ca(HCO3)2→2CaCO3↓+2H2O | |
| C. | 2NaOH+NH4HCO3→NH3?H2O+Na2CO3+H2O | |
| D. | NaOH+Ca(HCO3)2→2CaCO3↓+H2O+NaHCO3 |
8.元素R的气态氢化物为H2R,则它的最高价氧化物对应水化物的化学式为( )
| A. | HRO4 | B. | H2RO4 | C. | HRO3 | D. | H2RO3 |




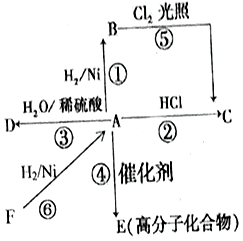 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.