题目内容
2.请写出下列反应的离子方程式.(1)稀盐酸和碳酸钠溶液CO32-+2H+=H2O+CO2↑
(2)铝片与硝酸汞溶液2Al+3Hg2+=3Hg+2Al3+
(3)硫酸铜和氢氧化钡溶液SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓
(4)澄清石灰水与少量二氧化碳CO2+Ca2++2OH-=CaCO3↓+H2O.
分析 (1)稀盐酸和碳酸钠溶液反应生成氯化钠、水和二氧化碳;
(2)铝片与硝酸汞溶液生成汞和硝酸铝;
(3)硫酸铜和氢氧化钡溶液反应生成氢氧化铜、硫酸钡;
(4)澄清石灰水与少量二氧化碳反应生成碳酸钙和水.
解答 解:(1)碳酸钠溶液与足量稀盐酸混合反应生成氯化钠、水、二氧化碳,离子反应为CO32-+2H+=H2O+CO2↑,
故答案为:CO32-+2H+=H2O+CO2↑;
(2)铝片与硝酸汞溶液反应生成硝酸铝和汞单质,反应的离子方程式为:2Al+3Hg2+=3Hg+2Al3+,
故答案为:2Al+3Hg2+=3Hg+2Al3+;
(3)硫酸铜和氢氧化钡溶液反应生成氢氧化铜、硫酸钡,离子方程式:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓;
故答案为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓;
(4)澄清石灰水与少量二氧化碳反应生成碳酸钙和水,离子方程式:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O.
点评 本题考查了离子方程式、化学方程式的书写,题目难度不大,注意掌握离子方程式、化学方程式的书写原则,能够正确书写常见反应的化学方程式,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
13.下列实验操作中正确的是( )
| A. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| B. | 做蒸馏操作时,冷凝水方向是下进上出 | |
| C. | 用溶解、过滤、蒸发的方法分离氯化钠与硝酸钾的混合物 | |
| D. | 用蒸发皿灼烧胆矾(CuSO4•5H2O)得到CuSO4 |
10.在强碱的无色溶液中,下列各组离子能大量共存的是( )
| A. | K+、Na+、NO3-、Br- | B. | Na+、NH4+、NO3-、Cl- | ||
| C. | K+、Na+、HCO3-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
17.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:NH4+、MnO4-、SO42-、CO32- | |
| B. | 在含大量 Ba2+的溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在 pH=1 的溶液中:K+、Fe2+、Cl-、CH3COO- |
14.下列反应中既属于离子反应,又属于氧化还原反应的是( )
| A. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | B. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | ||
| C. | NaCl+AgNO3═NaNO3+AgCl↓ | D. | Zn+CuSO4═Cu+ZnSO4 |
13.在一定温度下,反应 H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | 单位时间内生成1 mol的H2,同时生成2 mol 的HI | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 1mol I-I 键断裂的同时有2mol HI键形成 | |
| D. | 容器内气体颜色不再变化 |





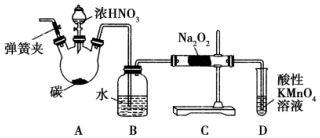 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.