题目内容
4.4FeS2+11O2=2Fe2O3+8SO2(已知FeS2中Fe为+2价)的反应中被氧化的元素是( )①Fe(+2)②Fe(+3)③S(-1)④O(0)⑤S(+4)
| A. | ①和③ | B. | 只有④ | C. | 只有③ | D. | 只有① |
分析 反应中Fe、S、O元素的化合价发生变化,其中Fe、S元素的化合价升高,O元素的化合价降低,以此解答该题.
解答 解:在4FeS2+11O2=2Fe2O3+8SO2的反应中,Fe的化合价从+2价升高到+3价,S的化合价从-1价升高到+4价,所以被氧化的是Fe(+2)和S(-1)④,故A正确.
故选A.
点评 本题考查氧化还原反应,题目难度不大,注意从元素化合价变化的角度判断,学习中要准确理解氧化还原反应的相关概念

练习册系列答案
相关题目
13.下列实验操作中正确的是( )
| A. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| B. | 做蒸馏操作时,冷凝水方向是下进上出 | |
| C. | 用溶解、过滤、蒸发的方法分离氯化钠与硝酸钾的混合物 | |
| D. | 用蒸发皿灼烧胆矾(CuSO4•5H2O)得到CuSO4 |
14.下列反应中既属于离子反应,又属于氧化还原反应的是( )
| A. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | B. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | ||
| C. | NaCl+AgNO3═NaNO3+AgCl↓ | D. | Zn+CuSO4═Cu+ZnSO4 |
9. 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
(1)取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.则稀释过程中溶液的pH由大到小的顺序a>c>b(填字母).
②配制250mL 0.4mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
③为标定该醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
该醋酸溶液的准确浓度为0.2000 mol/L(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是ad(多选、错选不得分).
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.0100 mol/L 醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于l.
②简述用pH试纸测 0.1mol/L 醋酸溶液pH的方法:用镊子取一小片pH试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照.
(3)常温下,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-)(选填“>”或“<”或“=”).
(4)若25℃时CH3COOH的电离平衡常数Ka=1.8×10-5 mol•L-1,向a L CH3COOH溶液中加入bmolCH3COONa,混合液恢复至25℃时呈中性,则原CH3COOH溶液的浓度为$\frac{b}{180a}$mol•L-1.
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.(1)取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.则稀释过程中溶液的pH由大到小的顺序a>c>b(填字母).
②配制250mL 0.4mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
③为标定该醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
②简述用pH试纸测 0.1mol/L 醋酸溶液pH的方法:用镊子取一小片pH试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照.
(3)常温下,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-)(选填“>”或“<”或“=”).
(4)若25℃时CH3COOH的电离平衡常数Ka=1.8×10-5 mol•L-1,向a L CH3COOH溶液中加入bmolCH3COONa,混合液恢复至25℃时呈中性,则原CH3COOH溶液的浓度为$\frac{b}{180a}$mol•L-1.
16.下列不能表示2mol HCl的是( )
| A. | 2mol/L的稀盐酸1L | B. | 73gHCl | ||
| C. | 44.8LHCl | D. | 1.204×1024个HCl分子 |
13.在一定温度下,反应 H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | 单位时间内生成1 mol的H2,同时生成2 mol 的HI | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 1mol I-I 键断裂的同时有2mol HI键形成 | |
| D. | 容器内气体颜色不再变化 |
14.下列有关性质的比较,用元素周期律解释不合理的是( )
| A. | 酸性:H2SO4<H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 稳定性:HF>HCl |
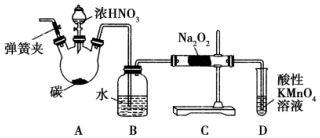 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.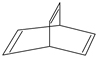 有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为
有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
.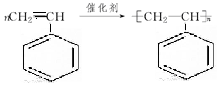 .
.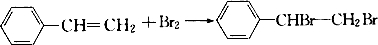 .
.