题目内容
在0.01mol?L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是多少?当Mg2+完全沉淀时,溶液的pH为多少?[Ksp(Mg(OH)2)=1.8×10-11].
考点:pH的简单计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:已知c(MgCl2)=0.01mol?L-1,逐滴加入NaOH溶液,刚好出现沉淀时,c(Mg2+)=0.01mol/L,依据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算c(OH-),然后根据Kw=1.0×10-14计算c(H+);同理:当Mg2+完全沉淀时,可根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算c(OH-),然后根据Kw=1.0×10-14计算c(H+),进而计算pH,当溶液中离子浓度小于1.0×10-5认为沉淀完全.
解答:
解:已知c(MgCl2)=0.01mol?L-1,逐滴加入NaOH溶液,当刚好出现沉淀时,c(Mg2+)=0.01mol/L,故c(OH-)=
mol/L=4.2×10-5mol/L,c(H+)=
=2.4×10-10mol/L,故pH=9.6,即当pH=9.6时,氢氧化镁开始沉淀;
一般认为:溶液中离子浓度小于1.0×10-5沉淀完全,故镁离子完全沉淀时有:c(Mg2+)=1.0×10-5mol/L,故c(OH-)=
mol/L=1.34×10-3mol/L,c(H+)=
=7.46×10-12mol/L,故pH=11.1,即当pH=11.1时,氢氧化镁沉淀完全,故答案为:9.6;11.1.
|
| 1.0×10-14 |
| 4.2×10-5 |
一般认为:溶液中离子浓度小于1.0×10-5沉淀完全,故镁离子完全沉淀时有:c(Mg2+)=1.0×10-5mol/L,故c(OH-)=
|
| 1.0×10-14 |
| 1.34×10-3 |
点评:本题主要考查的是溶度积常数的计算以及应用,熟记公式是解决本题的关键,另外需知完全沉淀的概念,难度不大.

练习册系列答案
相关题目
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A、过氧化钠与水反应生成11.2L(标准状况下)氧气,反应中转移的电子数约为2NA |
| B、常温常压下,22.4L NO气体的分子数小于NA |
| C、常温常压下,0.5 mol?L-1的乙酸溶液中,乙酸分子的数目小于0.5NA |
| D、7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
下列有关实验的做法或说法正确的是( )
| A、在制备乙烯的实验中,为了防止反应产生副产物,加热时应使温度迅速上升至170°C |
| B、分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,并在水浴中加热,乙酸乙酯香味散失的速度按氢氧化钠、水、稀硫酸的顺序依次减慢 |
| C、将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 |
| D、向苯酚钠稀溶液中,通入少量二氧化碳气体,溶液中生成碳酸钠 |
丙烯醇(CH2═CH-CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④与钠反应.
①加成 ②氧化 ③燃烧 ④与钠反应.
| A、①②③ | B、②③④ |
| C、①②③④ | D、①③④ |
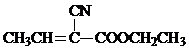 )是合成某种手术用粘合剂的单体,X的合成路线如图:
)是合成某种手术用粘合剂的单体,X的合成路线如图: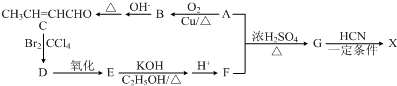

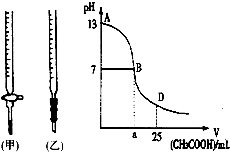 图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:
图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答: