题目内容
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A、过氧化钠与水反应生成11.2L(标准状况下)氧气,反应中转移的电子数约为2NA |
| B、常温常压下,22.4L NO气体的分子数小于NA |
| C、常温常压下,0.5 mol?L-1的乙酸溶液中,乙酸分子的数目小于0.5NA |
| D、7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
考点:阿伏加德罗常数
专题:
分析:A.过氧化钠中的氧元素 化合价为-1价,根据氧气的物质的量计算出转移的电子数;
B.气体体积与温度和压强有关,温度升高或减小压强都可使气体体积增大,反之降低;
C.没指明溶液的体积无法计算;
D.硫化钠和过氧化钠的摩尔质量相等,1mol过氧化钠中含有1mol阴离子.
B.气体体积与温度和压强有关,温度升高或减小压强都可使气体体积增大,反之降低;
C.没指明溶液的体积无法计算;
D.硫化钠和过氧化钠的摩尔质量相等,1mol过氧化钠中含有1mol阴离子.
解答:
解:A.标况下11.2L氧气的物质的量为0.5mol,过氧化钠与水反应生成0.5mol氧气,需要转移1mol电子,转移NA个电子,故A错误;
B.标准状况下,22.4L NO气体的物质的量为1mol,分子数为NA.常温常压下,温度升高,体积膨胀,故22.4L NO物质的量小于1mol,气体的分子数小于NA,故B正确;
C.没指明溶液的体积无法计算,故C错误;
D.1mol过氧化钠中含有1mol阴离子,7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA,故D错误;
故选:B.
B.标准状况下,22.4L NO气体的物质的量为1mol,分子数为NA.常温常压下,温度升高,体积膨胀,故22.4L NO物质的量小于1mol,气体的分子数小于NA,故B正确;
C.没指明溶液的体积无法计算,故C错误;
D.1mol过氧化钠中含有1mol阴离子,7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA,故D错误;
故选:B.
点评:本题考查阿伏加德罗常数的有关计算和判断,明确过氧化钠中氧元素为-1价依据过氧化钠中含有1个过氧根离子为解题关键,注意气体摩尔体积的使用条件.

练习册系列答案
相关题目
下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
⑤SiO2是酸性氧化物,故不与酸反应.
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
⑤SiO2是酸性氧化物,故不与酸反应.
| A、①② | B、②③ | C、①④ | D、③④ |
下列离子方程式中,属于水解反应的是( )
| A、CH3COOH+H2O?CH3COO-+H3O+ |
| B、CO2+H2O?H2CO3 |
| C、CO32-+H2O?HCO3-+OH- |
| D、HCO3-+OH-?CO32-+H2O |
下列反应中,属于氧化还原反应的是( )
| A、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| B、HCl+NaOH=NaCl+H2O |
| C、Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓ |
| D、CuCl2+Fe=FeCl2+Cu |
下列溶液中含Cl-浓度最大的是( )
| A、10m1,0.1mol?L-1的AlC13溶液 |
| B、20m1,0.1mo1?L-1的CaC12溶液 |
| C、30m1,0.2mo1?L-1的KC1溶液 |
| D、100m1,0.25mo1?L-1的NaC1溶液 |
下列有机物的结构简式书写正确的是( )
A、TNT  |
B、硬脂酸甘油酯 |
| C、乙酸甲酯 CH3OOCCH3 |
| D、3-甲基丁醛 (CH3)2CHCH2COH |
图Ⅰ是NO2(g)+CO(g)?CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ,下列有关说法正确的是( )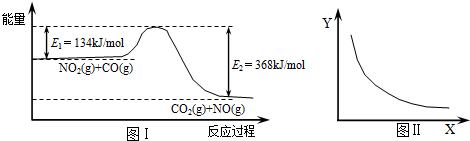

| A、该反应的焓变△H=+234 kJ?mol-1 |
| B、若X表示体系的压强,则Y表示的可能是NO2的转化率 |
| C、若X表示温度则Y表示的可能是CO2物质的量浓度 |
| D、增大CO的起始浓度,平衡向正反应方向移动,反应热增大 |