题目内容
把5.4g铝放入足量氢氧化钠溶液中完全反应,计算:
(1)生成氢气的体积;
(2)反应后所得溶液为50mL,求溶液的物质的浓度.
(3)反应中转移电子的物质的量.
(1)生成氢气的体积;
(2)反应后所得溶液为50mL,求溶液的物质的浓度.
(3)反应中转移电子的物质的量.
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据n=
计算5.4gAl的物质的量,由方程式计算生成氢气的物质的量和体积;
(2)根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑由Al的物质的量求出偏铝酸钠的物质的量,再求出浓度;
(3)根据方程式分析转移的电子的物质的量.
| m |
| M |
(2)根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑由Al的物质的量求出偏铝酸钠的物质的量,再求出浓度;
(3)根据方程式分析转移的电子的物质的量.
解答:
解:(1)5.4gAl的物质的量=
=0.2mol,设生成的氢气为xmol,
则 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.2mol xmol
所以x=
mol=0.3mol,则氢气的体积为:0.3mol×22.4L/mol=6.72L;
答:生成氢气的体积为6.72L;
(2)令生成的偏铝酸钠的物质的量为ymol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 2
0.2mol ymol
则y=0.2mol,溶液的浓度为c(NaAlO2)=
=
=4mol/L;
答:溶液的物质的浓度为4mol/L;
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑反应中1molAl失去3mol电子,则0.2molAl失去0.6mol电子;
答:反应中转移电子的物质的量0.6mol.
| 5.4g |
| 27g/mol |
则 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.2mol xmol
所以x=
| 0.2mol×3 |
| 2 |
答:生成氢气的体积为6.72L;
(2)令生成的偏铝酸钠的物质的量为ymol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 2
0.2mol ymol
则y=0.2mol,溶液的浓度为c(NaAlO2)=
| n |
| V |
| 0.2mol |
| 0.05L |
答:溶液的物质的浓度为4mol/L;
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑反应中1molAl失去3mol电子,则0.2molAl失去0.6mol电子;
答:反应中转移电子的物质的量0.6mol.
点评:本题考查根据方程式的计算、常用化学计量计算,题目比较基础,注意基础知识的积累掌握和公式的应用.

练习册系列答案
相关题目
下列反应中,属于氧化还原反应的是( )
| A、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| B、HCl+NaOH=NaCl+H2O |
| C、Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓ |
| D、CuCl2+Fe=FeCl2+Cu |
图Ⅰ是NO2(g)+CO(g)?CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ,下列有关说法正确的是( )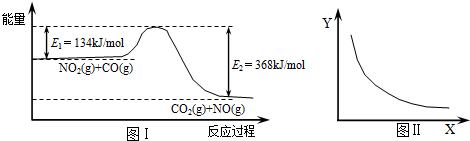

| A、该反应的焓变△H=+234 kJ?mol-1 |
| B、若X表示体系的压强,则Y表示的可能是NO2的转化率 |
| C、若X表示温度则Y表示的可能是CO2物质的量浓度 |
| D、增大CO的起始浓度,平衡向正反应方向移动,反应热增大 |


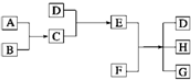 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
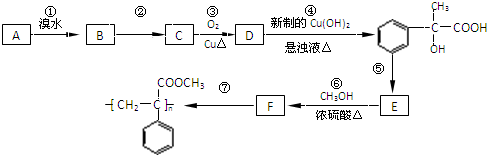
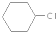 为原料合成重要的化工产品
为原料合成重要的化工产品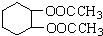 .合成路线流程图示例如下:
.合成路线流程图示例如下: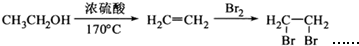 .
.