题目内容
5.如表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题.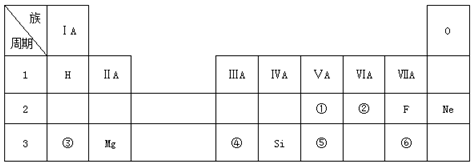
(1)②表示的元素是O(填元素符号);
(2)①、⑤两种元素的原子半径大小为:①<⑤(填“<”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③>④(填“<”或“>”);
(4)写出③与⑥两种元素所形成化合物的电子式
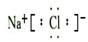 .
.(5)③、④两种元素的最高价氧化物的水化物碱性更强的是NaOH(填化学式)
分析 由元素在周期表中的位置知,①②③④⑤⑥分别是N、O、Na、Al、P、Cl元素,
(1)②位于第二周期第ⅥA族,是氧元素;
(2)根据元素在周期表中的位置可以确定①⑤分别为N、P,同主族自上而下原子半径逐渐增大;
(3)同周期自左而右元素金属性减弱;
(4)根据元素在周期表中的位置可以确定③⑥分别为Na、Cl,形成的化合物是离子化合物NaCl;
(5)元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:由元素在周期表中的位置知,①②③④⑤⑥分别是N、O、Na、Al、P、Cl元素,
(1)②表示O元素,故答案为:O;
(2)同主族自上而下原子半径增大,故原子半径①<⑤,故答案为:<;
(3)同周期自左而右元素金属性减弱,故金属性:③>④,故答案为:>;
(4)③位于第三周期第ⅠA族,是Na元素,⑥位于第三周期第ⅦA族,是Cl元素,形成的化合物是离子化合物NaCl,电子式为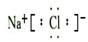 ,
,
故答案为: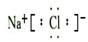 ;
;
(5)金属性:③>④,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故答案为:NaOH.
点评 本题考查元素周期表的结构和元素周期律综合应用,为高考常见题型,通过元素在周期表中的位置确定是何种元素是解题的关键,试题比较基础,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.在某一容积为2L的密闭容器内,加入 0.12mol的CO和0.12mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如下表:
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=mol/(L•min),该温度下的平衡常数K=1.
(2)在体积不变的条件下,改变下列条件能使平衡常数变大的是A
A.升高温度 B.降低温度 C.加入催化剂 D.移出二氧化碳气体
(3)如要一开始加入0.04mol的CO、0.04mol的H2O、0.08mol的CO2和0.08mol的H2,在相同的条件下,反应达平衡时,c(CO)=0.03mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.12mol 的水蒸气,重新达到平衡后,CO的转化率升高(填“升高”、“降低”还是“不变”),CO2的质量分数降低(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,重新投料,测得在某一时刻c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此时v(正)<v(逆)(用“>”、“<”或“=”作答)
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
(2)在体积不变的条件下,改变下列条件能使平衡常数变大的是A
A.升高温度 B.降低温度 C.加入催化剂 D.移出二氧化碳气体
(3)如要一开始加入0.04mol的CO、0.04mol的H2O、0.08mol的CO2和0.08mol的H2,在相同的条件下,反应达平衡时,c(CO)=0.03mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.12mol 的水蒸气,重新达到平衡后,CO的转化率升高(填“升高”、“降低”还是“不变”),CO2的质量分数降低(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,重新投料,测得在某一时刻c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此时v(正)<v(逆)(用“>”、“<”或“=”作答)
16.将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生反应:2A(g)+B(g)?2C(g),2s时测得C的浓度为0.6mol•L-1.下列说法正确的是( )
| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.5mol•L-1 |
20.下列鉴别或者除杂方法可行的是( )
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
10.粗铜中含多种杂质(如锌、金和银等),工业上常用电解精炼法将粗铜提纯,在电解精炼时( )
| A. | 精炼时粗铜接电源负极 | |
| B. | 精炼时纯铜作阴极 | |
| C. | 杂质都将以单质形式沉积到池底 | |
| D. | 纯铜片增重2.56 g,电路中通过电子为0.04 mol |
17.下列关于硅及其化合物的说法不正确的是( )
| A. | SiO2和CO2一样能够与NaOH溶液反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅酸是一种比碳酸还弱的酸 | |
| D. | 硅的化学性质不活泼,常温下不与任何物质反应 |
