题目内容
14.0.1mol某有机物和0.2molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)(设O2无剩余),产物经过弄H2SO4,浓H2SO4质量增加5.4g:在通过灼热的CuO,充分反应后,CuO质量减轻1.6g:最后气体在通过碱石灰被完全吸收,碱石灰质量增加8.8g(1)通过计算确定该有机物的实验式,分子式、相对分子质量.
(2)若该有机物的红外光谱表明有-OH等吸收峰,核磁共振氢谱有两种类型的氢原子,写出该有机物的结构简式.
分析 浓硫酸具有吸水性,浓硫酸的质量增加5.4g,说明反应产物中含水5.4g,通过灼热氧化铜,由于发生反应CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2使固体的质量减轻,结合方程式利用差量法可计算CO的物质的量.通过碱石灰时,碱石灰的质量增加了8.8g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式,结合结构特点确定结构简式.
解答 解:(1)有机物燃烧生成水5.4g,物质的量为$\frac{5.4g}{18g/mol}$=0.3mol,
令有机物燃烧生成的CO为x,则:
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,固体质量减少△m
28g 16g
x 1.6g
所以x=2.8g,CO的物质的量为$\frac{2.8g}{28g/mol}$=0.1mol.
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.1mol,质量为0.1mol×44g/mol=4.4g.
有机物燃烧生成的CO2的质量为8.8g-4.4g=4.4g,物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,
根据原子守恒可知,有机物分子中N(C)=$\frac{0.1mol+0.1mol}{0.1mol}$=2,N(H)=$\frac{0.3mol×2}{0.1mol}$=6,N(O)=$\frac{0.1mol×2+0.1mol+0.3mol-0.2mol×2}{0.1mol}$=2,
所以有机物的分子式为C2H6O2,相对分子质量为62.
答:该有机物的实验式为CH3O,分子式为C2H6O2、相对分子质量为62;
(2)若该有机物的红外光谱表明有-OH等吸收峰,核磁共振氢谱有两种类型的氢原子,则结构应为CH2OHCH2OH,
答:该有机物的结构简式为CH2OHCH2OH.
点评 本题考查有机物的推断,为高考常见题型,利用燃烧法确定有机物分子式、有机物结构的判断、官能团的性质等,难度中等,掌握原子守恒判断有机物的分子式方法.

| A. | 工业生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | CO会与血红蛋白结合,使人中毒;可将中毒病人放入高压氧仓中解毒,其解毒原理符合平衡移动原理 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
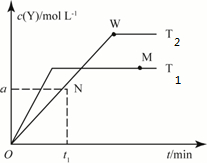 ( )
( )| A. | T2下,在0~t1时间内v(X)=$\frac{a}{{t}_{1}}$mol•L-1•min-1 | |
| B. | N点时气体的总压强大于W点时气体的总压强 | |
| C. | M点的正反应速率小于N点的逆反应速率 | |
| D. | W点时再加入一定量Y,平衡后X的转化率减小 |
| A. | 酸性溶液Na+、K+、MnO4-、Fe2+ | B. | 酸性溶液Fe3+、NH4+、SCN-、NH3+ | ||
| C. | 碱性溶液Na+、K+、AlO2-、SO42- | D. | 碱性溶液Ba2+、Na+、HCO3-、Cl- |
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是正极 | |
| C. | 电子沿导线由锌流向铜,在铜极上氢离子得到电子而放出氢气 | |
| D. | 铜锌原电池工作时,锌溶解,所以才产生电子 |
| A. | 钠在氯气中燃烧制氯化钠 | |
| B. | 二氧化锰和浓盐酸共热制氯气 | |
| C. | 氯气与消石灰反应制漂白粉 | |
| D. | 氢气、氯气混合光照后的产生溶于水制盐酸 |
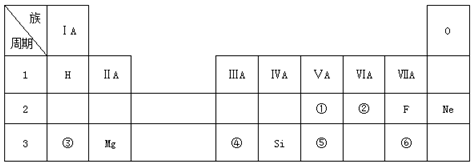
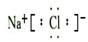 .
.