题目内容
16.将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生反应:2A(g)+B(g)?2C(g),2s时测得C的浓度为0.6mol•L-1.下列说法正确的是( )| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.5mol•L-1 |
分析 v(C)=$\frac{0.6mol/L}{2s}$mol/(L.s)=0.3 mol•L-1•s-1,
A.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比;
B.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比;
C.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(A)=n(C)=1.2mol,A的转化率=$\frac{参加反应的物质的量}{初始物质的量}$×100%;
D.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×1.2mol=0.6mol,剩余n(B)=(2-0.6)mol=1.4mol,根据c=$\frac{n}{V}$计算平衡时B的浓度.
解答 解:v(C)=$\frac{0.6mol/L}{2s}$mol/(L.s)=0.3 mol•L-1•s-1,
A.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比,所以v(A)=v(C)=0.3 mol•L-1•s-1,故A正确;
B.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比,所以v(B)=$\frac{1}{2}$v(C)=$\frac{1}{2}$×0.3 mol•L-1•s-1=0.15mol•L-1•s-1,故B错误;
C.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(A)=n(C)=1.2mol,A的转化率为:$\frac{1.2mol}{4mol}$×100%=30%,故C错误;
D.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×1.2mol=0.6mol=0.6mol,剩余n(B)=(2-0.6)mol=1.4mol,则2s时B的浓度为c(B)=$\frac{1.4mol}{2L}$=0.7mol/L,故D错误;
故选A.
点评 本题考查化学平衡计算,题目难度中等,涉及反应速率、平衡浓度、转化率的计算,明确反应速率与计量数的关系是解本题关键,会根据公式进行推导,试题培养了学生的化学计算能力.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案| A. | Cl2水置于棕色试剂瓶避光保存 | |
| B. | 盛NaOH溶液的试剂瓶用磨口玻璃塞 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
| A. | 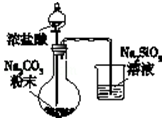 验证酸性:H2CO3>H2SiO3 | |
| B. | 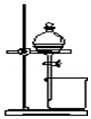 用于分离CCl4萃取碘水后的有机层和水层 | |
| C. | 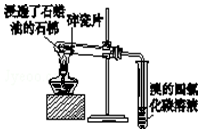 证明石蜡油分解生成的气体是乙烯 | |
| D. | 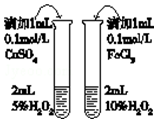 比较不同催化剂对反应速率的影响 |
| A. | NaOH溶液 | B. | 铁片 | C. | KSCN溶液 | D. | 石蕊溶液 |
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是正极 | |
| C. | 电子沿导线由锌流向铜,在铜极上氢离子得到电子而放出氢气 | |
| D. | 铜锌原电池工作时,锌溶解,所以才产生电子 |
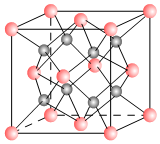 一种离子晶体的晶胞如图,其中阳离子A以
一种离子晶体的晶胞如图,其中阳离子A以  表示、阴离子B以
表示、阴离子B以  表示.
表示.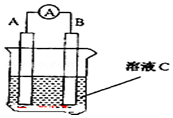 如图原电池装置图:
如图原电池装置图: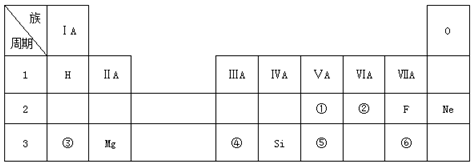
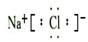 .
.