题目内容
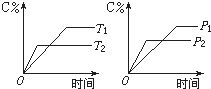
 如图所示,是在其他条件一定时,反应2A+B?2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )
如图所示,是在其他条件一定时,反应2A+B?2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )| A、X或Y两点相应,V(正)>V(逆) |
| B、Z、N两点表示未达平衡状态,且都是V(正)>V(逆) |
| C、W点表示非平衡状态,V(正)>V(逆) |
| D、相应反应速率大小的点:W>Y>N |
考点:转化率随温度、压强的变化曲线
专题:
分析:根据图片知,曲线表示不同温度下A的物质达到平衡时曲线,在该曲线上的X、Y点都是平衡状态,Z、W点都是非平衡状态,平衡状态时V(正)=V(逆),对于有气体参加或生成的可逆反应,压强越大反应速率越大,据此分析解答.
解答:
解:根据图片知,曲线表示不同温度下A的物质达到平衡时曲线,在该曲线上的X、Y点都是平衡状态,Z、W、N点都是非平衡状态,平衡状态时V(正)=V(逆),
A.X或Y两点都是平衡点,所以V(正)=V(逆),故A错误;
B.Z、N两点表示未达平衡状态,要使反应达到平衡状态,反应应该向正反应方向元素,所以这两点都是V(正)>V(逆),故B正确;
C.W点表示非平衡状态,要使该反应达到平衡状态,则应该减小A的转化率,平衡向逆反应方向移动,所以V(正)<V(逆),故C错误;
D.对于有气体参加或生成的可逆反应,压强越大反应速率越大,W、Y、N三点的压强大小顺序是N>Y>W,所以相应反应速率大小的点:W<Y<N,故D错误;
故选B.
A.X或Y两点都是平衡点,所以V(正)=V(逆),故A错误;
B.Z、N两点表示未达平衡状态,要使反应达到平衡状态,反应应该向正反应方向元素,所以这两点都是V(正)>V(逆),故B正确;
C.W点表示非平衡状态,要使该反应达到平衡状态,则应该减小A的转化率,平衡向逆反应方向移动,所以V(正)<V(逆),故C错误;
D.对于有气体参加或生成的可逆反应,压强越大反应速率越大,W、Y、N三点的压强大小顺序是N>Y>W,所以相应反应速率大小的点:W<Y<N,故D错误;
故选B.
点评:本题考查转化率随压强变化曲线,明确图片中纵横坐标的含义是解本题关键,知道曲线上任一点为平衡状态,曲线外都是非平衡状态,知道每一点对应正逆反应速率相对大小关系,题目难度中等.

练习册系列答案
相关题目
已知25℃时,电离平衡常数Ka(HF)=3.6×10-4 mol/L,溶度积常数Ksp(CaF2)=1.0×10-10 mol3/L3,Ksp(CaCO3)=5×10-9.现向50m L 0.2mol/L HF溶液中加入50mL 0.2mol?L-1 CaCl2溶液,则下列说法中,正确的是( )
| A、25℃时,0.1 mol/L HF溶液pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、向反应后的溶液中继续加入100m L 0.1 mol/L Na2CO3有CaCO3沉淀产生 |
| D、该体系中有CaF2沉淀产生,且反应后溶液中的F-浓度为1×10-4.5mol/L |
对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A、v(A)=0.01 mol/(L?s) |
| B、v(B)=0.04 mol/(L?s) |
| C、v(B)=0.60mol/(L?min) |
| D、v(C)=1.0mol/(L?min) |
 可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )
可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )| A、到达平衡后,若使用催化剂,C的质量分数增大 |
| B、平衡后,若升高温度,平衡则向逆反应方向移动 |
| C、平衡后,增大A的量,有利于平衡向正反应方向移动 |
| D、化学方程式中一定n>p+q |
在298K、1.01×105 Pa下,将22g CO2通入750mL 1mol/L NaOH溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1L 2mol/L NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
| A、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ/mol |
| C、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ/mol |
| D、2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ/mol |
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: